Intervención fisioterapéutica en alteraciones del hombro asociadas a tratamientos en cáncer de mama /Araya M. ISSN 2215-5562. Rev.Ter. Enero-Junio de 2021; Vol. 15 N°1: 54-78
ARTÍCULO DE REVISIÓN
Abordaje fisioterapéutico de las alteraciones funcionales del complejo articular del hombro debido a tratamientos oncológicos en cáncer de mama
Physiotherapeutic approach to the frequent functional alteration of the shoulder joint complex due to side effects of oncological treatments in breast cancer
Título corto: Intervención ffisioterapéutica en alteraciones del hombro asociadas a tratamientos en cáncer de mama.
Título corto: Intervención fisioterapéutica en el síndrome de mama fantasma doloroso
Autora: María Gabriela Araya Medrano.
Filiación: Fisioterapeuta Independiente, Alajuela, Costa Rica.
Correspondencia: María Gabriela Araya, correo electrónico: gatf03@gmail.com
Financiamiento: Ninguno.
Conflicto de interés: Ninguno.
Fecha de envío: 13 de julio del 2020
Fecha de aceptación: 23 de diciembre del 2020
Forma de citar: Araya-Medrano MG. Abordaje fisioterapéutico en las alteraciones funcionales frecuentes del complejo articular del hombro por efectos secundarios a tratamientos oncológicos en cáncer de mama. Rev Ter. 2021;15(1): 54-78.
Abreviaturas: AF: agentes físicos; BGC: biopsia del ganglio centinela; CaM: cáncer de mama; CAH: complejo articular del hombro; LA: linfadenectomía axilar; NME: neuromusculoesquelética; ROM: rango de movilidad articular.
Resumen
Introducción: el cáncer de mama (CaM) es uno de los más frecuentes, posee una alta tasa de supervivencia. Los sobrevivientes no solo deben enfrentar la enfermedad y secuelas, sino también, los efectos secundarios de tratamientos oncológicos. El objetivo de esta revisión fue establecer las intervenciones fisioterapéuticas seguras y efectivas para abordar las alteraciones funcionales del complejo articular del Hombro (CAH) que comprometen el rango de movilidad articular (ROM) ipsilateral en mujeres con CaM sometidas a tratamientos oncológicos (cirugía, quimioterapia, radioterapia). Metodología: estudio de revisión bibliográfica narrativa. Se consultaron recursos digitales como PubMed, LILACS, SciELO, Elsevier, RefSeek, Google Académico, Dialnet, Academia, Base, Springer Link, ERIC y Redalyc como fuente de documentos publicados (libros, tesis, artículos científicos). Se utilizaron los descriptores neoplasias de la mama OR radioterapia OR quimioterapia OR mastectomía AND articulación del hombro OR dolor de hombro OR lesiones de hombro, AND fisioterapia OR medicina física OR rehabilitación. Se incluyen documentos publicados durante los últimos 20 años, en español, inglés y portugués. Considerando la evidencia publicada, se proponen algoritmos de intervención fisioterapéutica en la limitación funcional del CAH asociada a tratamiento para el CaM. Resultados: conocidas las principales limitaciones del ROM del CAH en CaM, se establecen las modalidades fisioterapéuticas con respaldo en evidencia científica, para recuperar el ROM y la funcionabilidad del CAH. Algunas de estas son estímulos eléctricos, termoterapia (superficial y profunda), cinesiterapia, fisioterapia invasiva, vendaje neuromuscular y terapia manual. Conclusión: las mujeres con CaM sometidas a tratamientos oncológicos ven afectado el ROM del CAH. La fisioterapia ayuda a mitigar estas secuelas.
Palabras Clave: neoplasias de la mama, radioterapia, quimioterapia, mastectomía, dolor de hombro, lesiones de hombro, fisioterapia, rehabilitación.
Abstract
Introduction: breast cancer (BrC) is one of the most frequent with a high survival rate. Survivors must not only deal with the disease and its aftermath, but also with the side effects of cancer treatments. Objective: to establish safe and effective physiotherapeutic interventions to address functional alterations of the shoulder joint complex (SJC) that compromise the ipsilateral joint mobility range (JMR) in women with CaM undergoing cancer treatments (Surgery, Chemotherapy, Radiotherapy). Methodology: descriptive study of bibliographic review. Digital resources such as PubMed, LILACS, SciELO, Elsevier, RefSeek, Google Academic, Dialnet, Academia, Base, Springer Link, ERIC and Redalyc were consulted as a source of published documents (books, theses, scientific articles). The descriptors used were Breast Neoplasms OR Radiation Therapy OR Chemotherapy OR Mastectomy AND Shoulder Joint OR Shoulder Pain OR Shoulder Injuries, AND Physiotherapy OR Physiotherapy Modalities OR Physical Medicine and Rehabilitation OR Rehabilitation. Documents published during the last 20 years were included, in Spanish, English and Portuguese. Considering the published evidence, algorithms for physiotherapeutic intervention are proposed in the functional limitation of SJC. Results: once the main limitations of the JMR of the SJC in BrC have been established, the physiotherapeutic modalities were proposed with support and scientific evidence to recover the JMR and the functionality of the SJC. Some of these are electrical stimuli, thermotherapy (superficial and deep), kinesitherapy, invasive physiotherapy, neuromuscular bandage and manual therapy. Conclusion: women with BrC who underwent cancer treatments have JMR limitation in their SJC. Physiotherapy helps mitigate these sequelae.
Key Words: breast neoplasms, radiotherapy, chemotherapy, mastectomy, shoulder joint, physical therapy ,rehabilitation
Introducción
El cáncer de mama (CaM) es el cáncer más frecuente en mujeres en el mundo. Para el 2018 la incidencia mundial fue de 24,2% con una tasa de sobrevivencia del 87%1. La tasa de supervivencia general de las costarricenses con CaM durante 2000-2003, fue de 91,7% al primer año y de 71,5% a los cinco años2. Esta alta tasa se debe a la detección temprana y a la existencia de tratamientos efectivos3. Estas sobrevivientes se encuentran propensas a sufrir secuelas y/o efectos secundarios post- tratamiento.
La evidencia científica confirma que la morbilidad del brazo, incluyendo el complejo articular del hombro (CAH), afecta siete de cada ocho mujeres post-tratamiento contra CaM4. Las investigaciones consultadas concuerdan en que el tratamiento oncológico provoca efectos secundarios como dolor de brazo y hombro, fibrosis a relacionado con el CaM, restricción de la movilidad brazo y hombro5, daño nervioso y muscular; desencadenando dolor neuropático, pérdida de la fuerza, linfedema, neuropatía periférica, osteoporosis y fatiga6. Mencionan, además, otras secuelas como miopatía, tendinopatía y alteraciones en manguito rotador, capsulitis adhesiva, epicondilitis y síndrome post-mastectomía4. Los trastornos que generan dolor de la extremidad superior en mujeres con CaM relacionados con nervios son las más mencionadas (radiculopatía, plexopatía, neuropatía, polineuropatía, mononeuropatía múltiple, mononeuropatía, mononeuropatía mediana o síndrome del túnel del carpiano, neuropatía cubital, neuropatía radial y neuralgia intercostobraquial)7.
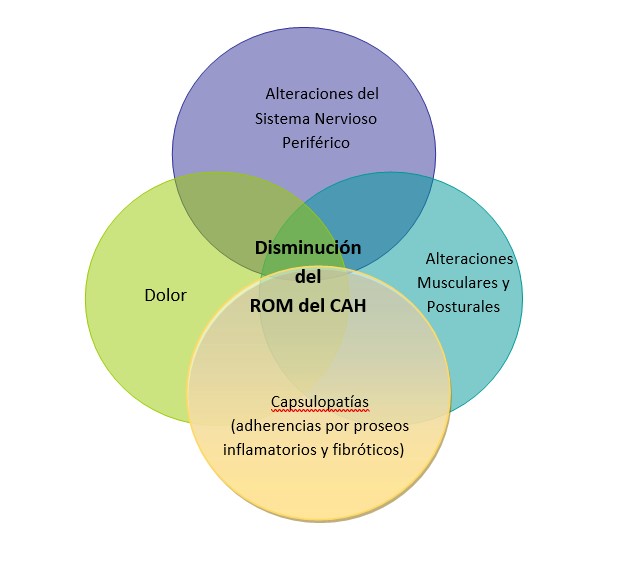
Por lo anterior, la presente revisión narrativa busca determinar cuáles son las alteraciones funcionales más frecuente del CAH y su relación con la disminución del ROM ipsilateral, secundarios a tratamientos oncológicos y finalmente proponer agentes físicos (AF) para su abordaje fisioterapéutico. La figura 1 muestra las causas más frecuentes mencionadas en los textos consultados que pueden llegar a afectar la funcionalidad del CAH al disminuir su capacidad de movilidad. Estas se pueden presentar de manera individual o entrelazadas entre sí y/o en conjunto con otras alteraciones y patologías que puedan alterar la ROM (por ejemplo, linfedema).

Figura 1: Causas de la limitación Funcional del CAH por disminución del RAM
Fuente: elaboración propia del autor
Metodología
El presente es un estudio de revisión bibliográfica de tipo cualitativo. Se utilizaron los buscadores PubMed, LILACS, SciELO, Elseiver, RefSeek, Google Académico, Dialnet, Academia, Base, Springer Link, ERIC y Redalyc. Así mimo, se consultaron libros sobre agentes físicos y rehabilitación. Los descriptores utilizados fueron: Neoplasias de la Mama OR Radioterapia OR Quimioterapia OR Mastectomía AND Articulación del Hombro OR Dolor de Hombro OR Lesiones de Hombro AND Fisioterapia OR Medicina Física y Rehabilitación OR Rehabilitación. Se consideraron los estudios de casos, metaanálisis, revisiones bibliográficas, libros, artículos en revisión y tesis en inglés, español y portugués entre los años 2000 y 2020. Además, se incluyeron dos documentos de publicación anterior al 2000 (1996 y 1999 respectivamente) por su relevancia.
La búsqueda arrojó un total de 789 documentos los cuales se seleccionaron de acuerdo con su título, resumen y consideraciones finales con el propósito de valorar la calidad y pertinencia con el tema. Se descartaron 57 documentos duplicados y 300 por criterios de exclusión (estudios con población meta diferente a mujeres con mastectomía radical simple o modificada, antigüedad de publicación mayor a 20 años, población meta con lesiones de hombro previas al CaM y linfedema como principal alteración de tratamientos oncológicos), así como artículos sobre hormonoterapia e inmunoterapia.
Se leyeron 432 documentos a cabalidad, descartando 349 debido a los criterios de exclusión ya mencionados. Se incluyeron para los resultados un total de 83 documento. En la figura 2, se puede observar el algoritmo de búsqueda, selección y extracción de la información. De acuerdo con los niveles de evidencia según Sackett, los artículos incluidos que se refieren a tratamientos Fisioterapéutico en disminución de la ROM en CAH fueron: 26 documentos de nivel de recomendación A, 35 documentos de nivel B, un documento de nivel C; cinco documentos de nivel D. Además, se incluyeron nueve libros, dos tesis, una página Web, un conceso médico y tres guías médicas. Estos documentos desarrollan temas sobre el tratamiento fisioterapéutico las alteraciones la funcionalidad del CAH y disminución del ROM y el uso seguro de AF. Para recomendar el uso de los AF en la limitación funcional del CAH se analiza las causas de la disminución del ROM de este, analizando los cambios fisiológicos que sufren los tejidos blandos con los tratamientos oncológicos.

Figura 2. Algoritmo de búsqueda, selección y extracción de la información
Discusión de resultados
En general, los tejidos blandos del CAH, se ven comprometidos debido a los fenómenos inflamatorios y de fibrosis inducidos por tratamientos oncológicos, ocasionando, inicialmente, pérdida en la elasticidad de los tejidos, seguida de una progresiva induración asociada a retracción de estos, generando hipoplasia, sequedad, ulceración e incluso, necrosis; fibrosis y atrapamiento de estructuras nerviosas u obliteración de estructuras vasculares8.
La actividad de la quimioterapia se centra en las células con un elevado índice mitótico, sin embargo, la falta de selectividad hace que puedan dañar células sanas, por ejemplo, los Taxanos pueden generar neuropatías responsables del dolor de la extremidad superior. Los órganos que se afectan con una mayor frecuencia por la quimiocitotoxicidad son la médula ósea y la piel, junto con sus anejos9.
El daño radioinducido en los tejidos por la radioterapia se debe a una respuesta aguda por la liberación de citoquinas de las células parenquimatosas, inflamatorias, endoteliales y del estroma del tejido irradiado, desencadenando una cascada de fenómenos inflamatorios que conducirán a una progresiva fibrosis (Paradigma de la toxicidad tardía severa post-radioterapia)8. El estímulo continuo y su traducción en forma de liberación constante de citoquinas, resulta en la expresión de citoquinas profibróticas que facilitan el establecimiento de la fibrosis. La radiación colocada a un lado del cuerpo puede desequilibrar las vértebras, los tejidos blandos y los músculos10. De manera prolongada, genera daños en los músculos; por otro lado, el daño en los tejidos óseos genera limitaciones funcionales, acortamiento de la extremidad, osteonecrosis, susceptibilidad a fracturas y curación lenta, y osteoporosis.
Las cirugías pueden generar alteraciones y complicaciones físicas, entre las más frecuentes se encuentran la adherencia pericicatricial, restricción de la amplitud de movimiento y dehiscencia cicatricial, lesión del nervio toracodorsal y el nervio torácico11. La mastectomía radical modificada puede generar reducción significativa en el ROM del CAH, principalmente en los movimientos de flexión y abducción activas y pasivas, así como en la fuerza muscular del trapecio medio y supraespinoso, en comparación con el miembro sano12.
En mujeres con CaM los movimientos mayormente restringidos son flexión y abducción del CAH13. En aquellas tratadas con radioterapia locorregional, con o sin quimioterapia (y hormonoterapia) se presenta una disminución en al menos uno de los movimientos del CAH ipsilateral en comparación del no afectado. Se considera que la movilidad del CAH se encuentra deteriorada si existe una diferencia de 25° en el ROM entre el brazo no afectado y el afectado14.
Según Johansen et al13 los trastornos más frecuentes en CAH relacionados con tratamientos oncológicos corresponden a entumecimiento (63%); dolor de CAH inespecífico (60%), fibrosis en la pared del pecho y/o zona axilar (45%). Armer et al15 mencionan que el entumecimiento, sensibilidad y el dolor son los síntomas más frecuentes. Por otro lado, Hopwood R et al16 mencionan que el 35% de las mujeres presentan mayormente dolor de brazo / hombro y alrededor del 20% rigidez del CAH.
Por su parte Stubblefield et al17 reportan que el ROM se encuentra restringida del 1,5% al 50% de las mujeres después del tratamiento del CaM; el dolor está presente del 12% al 51%; la debilidad de la extremidad superior está presente del 18% al 23% y el entumecimiento se encuentra del 29% al 81%. El músculo trapecio superior presenta mayor pérdida de actividad, seguido de los romboides y los músculos pectoral mayor y menor del lado afectado. Dicha disminución en la actividad muscular probablemente dará lugar a síndromes dolorosos y pérdida de uso funcional.
Un alto porcentaje de las mujeres sometidas a tratamiento para el CaM presenta alteraciones en el hombro del lado tratado; refieren el dolor como la queja más frecuente tanto al movimiento como al reposo. Las alteraciones posturales que se generan con mayor frecuencia son la protrusión de la cabeza, hombro descendido, escoliosis, cifosis y tensión en los tejidos blandos. Además, el rango de movimiento activo y pasivo del hombro es limitado y la pérdida de fuerza muscular en los músculos del manguito rotador18.
En resumen, las alteraciones de CAH que causan disminución del ROM más relevantes, y su relación con tratamientos oncológicos son:
1. Dolor: el dolor en las extremidades superiores es un problema común y debilitante para mujeres con CaM. La mayoría de los estudios sobre cáncer mencionan el dolor como un trastorno frecuente consecuente con los tratamientos oncológicos. Sin embargo, no se establece como causa o consecuencia de la limitación del ROM del CAH, ya que en ocasiones las mujeres con CaM evitan mover el CAH debido al dolor, produciendo un síndrome de inmovilidad; mientras que otras, presentan el síndrome de inmovilidad, el cual genera dolor en CAH al moverlo. El dolor agudo provoca alteraciones fisiopatológicas a nivel de órganos y sistemas que son capaces de alterar el curso de cualquier padecimiento, incluso se puede convertir en una enfermedad en sí mismo si no recibe un adecuado tratamiento19.
Algunas causas que generan dolor en miembro superior en CaM asociados a tratamientos oncológicos son: radiculopatía cervical, plexopatía braquial, neuropatía, tendinitis del manguito rotador, capsulopatía adhesiva, epicondilopatías, síndrome pos mastectomía, hinchazón y metástasis óseas4. Además, el dolor irradiado a brazo/hombro se asocia a niveles más altos de síntomas depresivos preoperatorios, ansiedad, trastornos del sueño, fatiga y niveles más bajos de atención función4.
2. Alteraciones en el Sistema Nervioso (periférico): las mujeres con CaM presentan una mecanosensibilidad elevada y generalizada en el sistema nervioso20. Los tratamientos oncológicos modifican la mecánica local del CAH, tórax y zona cervical. La radioterapia y la cirugía se relacionan con irritaciones del plexo braquial, lo que aumenta la mecanosensibilidad neural21. No obstante, los factores que aumentan la sensibilidad también pueden relacionarse con mecanismos no necesariamente locales. El estrés, la preocupación, las inferencias sociofamiliares poseen relación con los procesos patológicos nerviosos. La parestesia en seno es uno de los síntomas más frecuente post-radioterapia de ganglios linfáticos supraclaviculares; también se ven asociada con linfadenectomía axilar (LA), ya que esta técnica presenta más disestesias en el brazo que con BGC22. Las alteraciones como la radiculopatía cervical sintomática y otros trastornos pueden desarrollar o empeorar durante o después del tratamiento con quimioterapéuticos neurotóxicos23. Otra alteración nerviosa menos frecuente que la plexopatía cervical y la plexopatía braquial, como resultado de la invasión tumoral local, o como complicación tardía de la radioterapia y, en ambas se obtiene beneficios al trabajar con método conservador, incluyendo la fisioterapia4.
3. Desequilibrios posturales y musculares: el movimiento normal sin dolor del miembro superior requiere movimiento en la articulación glenohumeral y movimiento de la escápula en el tórax, esto se conoce como ritmo escapulohumeral y se requiere durante la elevación del brazo. En el post-tratamiento (mastectomía y/o radioterapia) se ha evidenciado alteraciones en este ritmo y su control muscular24. En los postoperatorios de CaM, se restringe el movimiento del CAH del lado afectado debido al dolor, la compresión de vendajes de la cirugía o la radiación y, a una tendencia protectora resultante del miedo o la ansiedad. Las limitaciones del movimiento, el dolor y la opresión de tejidos blandos alrededor del CAH causan restricción del ROM generando alteraciones en la biomecánica de la reja costal. La cohesión entre músculos, tejido subcutáneo, piel de la fosa axilar y del tórax influencian el funcionamiento del CAH25. Las condiciones de la estática del tronco llevan a un desorden en la simetría corporal, que produce una postura no adecuada. En el 54% de los casos con remoción del pectoral menor, hay presencia de atrofia y fibrosis del pectoral mayor con desórdenes en las funciones motoras del músculo, debido al daño del nervio torácico que corre vecino al pectoral menor. Como resultado de cirugía se dañan el nervio torácico y el toracodorsal, generando parálisis del músculo serrato anterior con la característica protrusión del hombro. Esto también ocurre en la parálisis del músculo dorsal ancho, llevando a desórdenes motores y alteración de la reja costal.
Por otro lado, la aplicación de la radioterapia lleva a cambios metabólicos al interior del músculo seguido de pérdida de las fibras musculares, reduciendo la fuerza muscular, y generando defectos funcionales y atrofia muscular26, alterando también la postura. Los músculos cercanos al CAH (pectoral mayor y menor) pueden tener un impacto en su morbilidad (por ejemplo, disminuir de tamaño) posterior a cirugía y/o radioterapia. Las mujeres tratadas por CaM poseen actividad muscular alterada en tres músculos clave del CAH (pectoral mayor, trapecio superior y romboide), a pesar de que dos último no se encuentran en el campo de la cirugía ni la radioterapia27.
Otro desorden frecuente es el Síndrome Cruzado Superior o Síndrome Cruzado Proximal de Hombro-Cuello. Este síndrome implica un desequilibrio muscular donde el pectoral mayor y menor, trapecio superior, elevador de la escapula y esternocleidoccipitomastoideo se aprietan y acortan, mientras que el trapecio inferior y medio, serrato anterior, romboides y flexores profundos del cuello (especialmente escalenos) se debilitan28. Tales cambios conllevan un aumento de la tensión del segmento cervical, la evolución de puntos gatillo (TrPs por sus siglas en inglés) en las estructuras estresadas y dolor referido al pecho, hombros y brazos. Se puede percibir un dolor semejante al que se percibe en la angina de pecho, por la tensión excesiva en el segmento de T4, y una disminución en la eficiencia respiratoria28.
4. Capsulopatía de CAH congelado o rigidez del CAH: es una complicación común en mujeres con CaM. Inicialmente se desencadena una sinovitis a causa de un trastorno que origina un movimiento restringido del CAH voluntario o subconscientemente (con el propósito de evitar maniobras dolorosas) y finalmente, se instaura la fibrosis capsular29. El pronóstico para la recuperación en una persona con CaM depende de la fase de cáncer y del tratamiento, por ejemplo, si la capsulopatía es resultado de la cirugía primaria de mama, generalmente posee un buen pronóstico, mientras que la capsulopatía adhesiva secundaria a una recurrencia del CaM axilar, posee peor pronóstico4. La rigidez del CAH se relaciona con radioterapia postoperatoria, ya que esta causa lesiones vasculares que pueden evolucionar a fibrosis y adherencias entre la piel y los músculos de la pared torácica, el CAH, cavidades supraclaviculares y axilares; deteriorando así el movimiento del CAH, y generando dolor, rigidez y fatiga30. Las mujeres con LA presentan mayor limitación de la movilidad y pérdida de fuerza en el CAH y brazo31. En el postoperatorio inmediato de LA (dos semanas) se restringen movimientos del CAH en la LA y en menor medida en la BGC, producida por el síndrome de la red axilar, adherencias, dolor o tirantez cicatricial del pectoral o de la herida32. Posterior a dos años tras la cirugía, las mujeres con LA mantienen una limitación del CAH en la rotación externa, abducción, flexión y abducción asociada con rotación externa, mientras que las que son sometidas a BGC mantienen la limitación en los dos últimos movimientos31. A consecuencia de esa rigidez se puede presentar una capsulopatía adhesiva de CAH, ya que cualquier trastorno que cause movimiento restringido del CAH puede causar sinovitis y finalmente la fibrosis capsular. Algunas causas de esta limitación puede ser el dolor incisional local por cirugía mamaria o axilar, reconstrucción mamaria, tendinopatía del manguito rotador, radiculopatía, recurrencia local del tumor, metástasis ósea, infección, radiación y linfedema, las anteriores comúnmente limitan el movimiento del CAH voluntaria o subconscientemente cuando la persona intenta evitar maniobras dolorosas15. El diagnóstico se hace sobre la base de restricción pasiva el ROM de CAH, en concordancia con la mayoría de los autores consultados, Stubblefield et al4 mencionan que todos los movimientos del CAH se ven restringidos, pero en mayor medida en la rotación externa y abducción.
Técnicas fisioterapéuticas utilizadas en las alteraciones del CAH
La aplicación de las modalidades fisioterapéuticas mencionadas en este documento se encuentra sujeta al criterio profesional, evaluaciones médicas, valoraciones fisioterapéuticas, experiencia previa, ética biomédica, y conocimiento fisioterapéutico científico para elegir estas u otras técnicas.
Además, se considera fundamental la educación de la persona por tratar sobre las posibles complicaciones, riesgos, beneficios, sensaciones y otras consideraciones consecuentes del tratamiento fisioterapéutico. Por último, se recomienda el uso de un consentimiento informado, donde se exprese lo anterior y la persona manifieste su anuencia ante el tratamiento. Tomando en cuenta estas medidas, se puede garantizar los principios éticos fundamentales (menor maleficencia, beneficencia, justicia y autonomía).
Antes de explicar los agentes físicos (AF) recomendados, se debe esclarecer el resultado de la acción mecánica sobre o en las inmediaciones del cáncer, y su relación con el riesgo de metástasis, en especial si está cerca de la piel, a pesar de que las células cancerígenas poseen escasas probabilidades de sobrevivir33. La metástasis no es un proceso meramente mecánico influenciable por estímulos mecánicos; por el contrario, es un proceso complejo en el que están involucrados genes, no influenciables por estímulos mecánicos34. A pesar de esto, existe evidencia que defiende que, la metástasis puede poseer influencia biomecánica sí el estímulo se aplica local o directamente sobre el cáncer35.
El uso de AF se debe basar en contraindicación y precaución del estímulo de acuerdo con sus efecto local y sistémico. Según la bibliografía consultada, la termoterapia profunda (láser, ultrasonido, onda corta, microonda, radiofrecuencia), la estimulación eléctrica, el calor superficial y ondas de choque están contraindicadas a nivel local en cáncer activo. Mientras que el Biofeedback (sin electroestimulación) se pueden aplicar sin problema a nivel local36-38.
Seguidamente se analizan algunos de los AF que se consideran para el abordaje de las alteraciones funcionales del CAH:
1. Terapia manual
La aplicación de terapias manuales (como la terapia de liberación miofascial, técnicas de liberación de adherencias, masoterapia, estimulación de puntos gatillo miofasciales, masaje) combinados con ejercicios de estabilidad y un programa estándar de ejercicios terapéuticos de fisioterapia en CaM logra disminuir la inflamación y dolor, mejorar la funcionalidad de las articulaciones, aumentar de la fuerza muscular, y, por lo tanto, la calidad de vida de las mujeres39,40. Se desarrolla de manera breve algunas de las técnicas de terapia manual que se pueden aplicar.
a) Masaje: con el masaje este se busca disminuir el dolor, contracturas, adherencias. No existe evidencia que el masaje pueda extender el cáncer (aunque no se debe realizar presión directa sobre el tumor)41 por el contrario, se ha evidenciado el masaje como reductor del dolor, de la ansiedad y de efectos adversos de la quimioterapia42, sin embargo, no se debe aplicar masajes, si cabe la posibilidad de una neoplasia primaria o metastásica en la piel o el tejido subcutáneo en el sitio de aplicación ya que se podría provocar el desprendimiento de células. Se pueden aplicar técnicas como effleurage, petrissage, fricciones, compresiones, amasamiento digital, estiramientos pasivos, asistidos, percusiones, presiones, movimientos circulares con dedos centrífugamente.
b) Liberación de puntos gatillo: una de las causas de dolor en mujeres con CaM son los puntos gatillo o trigger points (TrPs), especialmente en músculos del cuello y del hombro43. Se recomienda estimular los TrPs del cuello, hombro, axila y la zona pectoral específicamente los músculos que se encuentren tónicos en el síndrome cruzado posterior (pectoral mayor y menor, trapecio superior, elevador de la escapula y esternocleidoccipitomastoideo). La inhibición de los TrPs puede ser beneficiosa para reducir el dolor y prevenir restricciones de la movilidad del hombro en el dolor44, así mismo, las estrategias basadas en la mejora de la movilidad y resistencia muscular podrían reducir el uso de fármacos.
c) Técnica de ahorro de energía muscular: esta técnica de centra en el tejido muscular y en la movilización articular y posee como objetivos desarrollar la fuerza de músculos débiles, liberar la hipertonicidad, mejorar la función musculoesquelética, movilizar las articulaciones cuando sus movimientos se encuentran restringidos y mejorar la circulación local45. Se utiliza para estirar músculos acortados, tensos y espásticos; para reforzar un músculo o grupo muscular fisiológicamente debilitado; y con esto reducir el edema localizado, aliviar la congestión pasiva y movilizar una articulación con una movilidad restringida46.
d) Inducción (liberación o/y elongación) miofascial: se basa en la manipulación del tejido miofascial para tratar alteraciones funcionales. Algunos estudios han demostrado que la aplicación de técnicas de inducción miofascial proporciona efectos de hipoalgesia47. La inducción miofascial, compresión isquémica o liberación por presión en TrPs de musculatura de cuello y hombro disminuyen la intensidad de dolor y aumentan el umbral del dolor a la presión de estos puntos en mujeres intervenidas por CaM48. Una vez eliminados los TrPs, las cualidades de extensibilidad y fuerza de los músculos se ven restauradas, así como el umbral de tolerancia al movimiento, logrando incluir técnicas de movilización articular suave, y en fases más avanzadas, ejercicios de control escapular49. Se recomiendan las técnicas de elongación miofascial de cadena antero interna de hombro y anterior de brazo en conjunto con técnicas de energía muscular43.
e) Masaje transverso de Cyriax: este tipo de masaje es recomendado en la movilización de la cicatriz (ya que esta puede presentar adherencias) junto a movilizaciones del CAH para aportar elasticidad, evitar adherencias y mejorar la movilidad del hombro50. Se recomienda realizar estiramiento y la hidratación de la región de cicatricial ya que mejora la circulación de la zona. La aplicación del masaje transverso de Cyriax debe ser una vez retirados los puntos de sutura y el drenaje. Se debe friccionar la cicatriz quirúrgica con los dedos, ejerciendo presión hasta alcanzar las estructuras profundas situadas debajo de la piel y del tejido subcutáneo (músculos, tendones y ligamentos lesionados) de esta forma se mejora también la movilidad del hombro que inicia habitualmente a partir de los 7-10 días postoperatorios, en esta etapa ya se permite la movilidad completa de los arcos de movimiento, las rotaciones e incluso trabajar con un peso extra2.
2. Crioterapia
Estas técnicas son utilizadas para el tratamiento del dolor en afecciones neuromusculoesqueléticas (NME), ya que disminuye la velocidad de conducción en nervios motores y sensitivos, bloquea reversiblemente puntos superficiales nerviosos, además, por estimulación de las fibras aferentes gruesas, produce modulación del dolor a nivel medular (teoría de la Puerta de Dolor)51. Se recomienda su uso tanto de manera local como distal en cáncer, considerando las precauciones y contra indicaciones generales.
3. Vendaje neuromuscular o Kinesio Tape (KT)
El KT puede utilizarse para conseguir distintos objetivos en base a sus propiedades. Los efectos que se consiguen varían en función de la colocación del vendaje: para aumentar la contracción muscular se coloca desde el inicio a la inserción del músculo debido a la fuerza concéntrica, y para relajar el musculo se aplica la inserción al inicio del músculo provocando así una fuerza excéntrica sobre la fascia que permitiría la relajación del mismo52. También se puede lograr estimulación del mecanismo neurorreflejo, disminución del dolor, mejor circulación venosa y linfática bajo piel (logrando reparar tejidos dañados)53. Este vendaje otorga libertad de movimiento, logra la facilitación propioceptiva, la facilitación muscular; reduce la fatiga muscular, las agujetas, el dolor; y mejora la recuperación y el flujo linfo-sanguíneo54,55. Además, ayuda a la función articular, por medio de la estimulación de la propiocepción; la corrección de la posición articular y de la dirección del movimiento; y aumenta la estabilidad56. Se ha demostrado que en hombro congelado (no relacionado a CaM) posterior a la aplicación de KT combinado con infiltración con corticoides y anestésico local más ejercicios, se observan resultados favorables (disminución del dolor, mayor amplitud del RAM de CAH)57. Por tanto, se puede recomendar su uso para recuperar el ROM del CAH en mujeres con CaM, sim embargo, no existe suficiente evidencia sobre su aplicación en este tema en específico.
4. Técnicas Invasivas de Fisioterapia
Como ya se mencionó anteriormente, existe una relación entre la afectación de los TrPs con el dolor y la limitación funcional del CAH en mujeres con CaM. Por tanto, se recomienda las técnicas invasivas de fisioterapia como una opción para tratar los TrPs.
a) Punción seca: es una técnica invasiva que utiliza agujas similares a las de acupuntura, pero más largas (dependiendo de la profundidad del musculo a tratar) para el tratamiento del síndrome del dolor miofascial provocado por dolor en los puntos gatillo miofasciales. Se ha establecido la eficacia en mujeres sometidas quirúrgicamente de reconstrucción mamaria diferida bajo técnica de colgajo dorsal con expansor con cuadro de dolor en la región torácica derecha con limitación funcional del hombro derecho58. Se recomienda la Técnica de Entrada y Salida Rápida de Hong, en caso de encontrar dolor referido en músculos cercanos a la zona mamaría (trapecio superior, dorsal ancho, pectoral mayor, serrato anterior). No se recomienda aplicar en músculos de la parrilla costal o sobre esta, salvo el terapeuta se encuentre académicamente capacitado y la persona se encuentre enterada del riesgo de neumotórax.
5. Ejercicio Físico
El ejercicio se ha estudiado ampliamente en toda la atención del cáncer, desde las intervenciones previas al tratamiento59-61.así como durante el tratamiento activo62,63 y después de finalizado el tratamiento64. Se evidencian efectos positivos durante las intervenciones de ejercicios aeróbicos y de resistencia durante el tratamiento adyuvante en personas con CaM, además, ayuda a mitigar o prevenir los efectos secundarios del tratamiento oncológico. Es una intervención de autocuidado, mejora el estado físico y la capacidad de realizar las actividades de la vida diaria65. Cabe mencionar que se debe considerar si hay compromiso cardíaco, debido a los agentes quimioterapéuticos cardiotóxicos, para ejecutar un programa de ejercicios66. Así mismo, se deben considerar las recomendaciones del <span">American Colege of Sports Medicin<span ">e67,68 para la valoración y prescripción de ejercicio físico en personas con cáncer.
a) Movilizaciones pasivas asistidas resistidas: las movilizaciones del CAH, ya sean pasivas, asistidas o resistidas, poseen como objetivo favorecer la movilidad del hombro en mujeres con CaM y evitar la retracción del músculo pectoral. Se busca los movimientos dirigidos al aumento de amplitud sobre todo en abducción y rotación externa, así como de la fuerza muscular, siempre evitando el dolor en medida de lo posible y facilitando la movilización activa y/o pasiva. Se ha demostrado que tanto las técnicas articulatorias como la movilización neurodinámica son abordajes fisioterapéuticos eficaces para recuperar la limitación de la movilidad de hombro tras cirugía mamaria con linfadenectomía. Además, estas técnicas mejoran el dolor, la alteración de la sensibilidad y la funcionalidad del miembro superior en estas mujeres69.
6. Estímulos Eléctricos
Generalmente el uso de todos los AF electromagnéticos se encuentran contraindicados directamente sobre un tumor maligno o adyacente a él debido a preocupaciones sobre la estimulación de la proliferación de células malignas y el crecimiento tumoral70. El uso de otros estímulos eléctricos tanto de alta, media y baja frecuencia, están contraindicados en aplicaciones locales, es decir sobre la masa tumoral71, por lo que sería seguro utilizarlas a distal al tumor primario, considerando sus otras contraindicaciones y precauciones.
a) TENS: es una corriente eléctrica de baja frecuencia, con una forma de onda bifásica asimétrica. El tratamiento con TENS en mujeres con dolor intercostobraquial post mastectomía, modifica la región parietal y disminuye el dolor72. Además, el TENS proporciona un complemento beneficioso para el tratamiento del dolor por cáncer, especialmente cuando se utiliza como terapia dirigida a un objetivo73. La aplicación del TENS es beneficioso en los síntomas del dolor y la calidad de vida durante un período de don meses en personas con cáncer con dolor (por metástasis, quimioterapia, cirugía y radiación)74. Sin embargo, los estudios no son concluyentes en recomendar el TENS en personas con cáncer debido a que las investigaciones realizadas son heterogéneas y con fallos en el diseño de estudio75-77.
b) EMS: esta es una corriente de baja frecuencia con una forma de onda cuadrada capaz de trabajar directamente sobre las motoneuronas del músculo. Este tipo de corriente se usa ampliamente para aumentar la fuerza, ayudar con reeducación muscular y controlar los espasmos agudos. En CaM, existen pocos datos publicados sobre el uso de EMS78. Aunque no se ha encontrado ningún evento adverso grave relacionado con EMS en personas con cáncer; la conclusión actual menciona que no hay ninguna diferencia entre los grupos de personas con cáncer tratados EMS y las abordadas con ejercicios físico, por tanto, su aplicación no suficientemente aceptable ya que puede no ser práctico78. Esto abre un campo de estudio para conocer el efecto de la EMS en mujeres con limitación funcional del ROM del CAH.
c) Myofeedback o Corrientes Moduladas de Bernard: son corrientes de baja frecuencia (básiCaMente dos 50 y 100Hz), con una forma de onda bifásica asimétrica, aplicadas en distintas modulaciones o combinaciones entre ambas frecuencias fundamentales. Permite romper la barrera de funciones biológicas consideradas neurovegetativas o no controlables por la actividad voluntaria. El proceso básico parte de una electromiografía que mide la contracción y relajación del músculo en estudio. Los equipos de Myofeedback amplifican la actividad eléctrica originada en el músculo tratado y la traduce a señales auditivas o visuales de aumento o decremento dependiendo de la actividad electromiográfica (principio de la bio-retroalimentación)79. La evidencia en su aplicación en Cáncer es escasa, sin embargo, es segura su aplicación a nivel distal con electroestimulación y de manera local sin electroestimulación37. En términos generales el Miofeedback presenta ventajas, ya que al entregar retroalimentación inmediata, genera mayor motivación de los usuarios; lo cual favorece la adherencia al tratamiento; la retroalimentación, así como la motivación, juegan un papel fundamental en la readquisición de habilidades, lo que puede ser un aporte a los tratamientos en general, tomando estos dos factores como premisas en los tratamientos de rehabilitación en general y se podría extender su uso en la limitación funcional del CAH.
7. Oscilación profunda:
Las oscilaciones profundas provocan un campo magnético electrostático intermitente que actúa sobre el tejido conectivo mediante campos electrostáticos generando una intensa vibración resonante en los tejidos involucrados80. Se ha demostrado que el uso de las oscilaciones profundas es eficaz en el tratamiento del proceso inflamatorio y en los cambios histológicos proliferativos de la enfermedad fibroquística de mama post CaM81. Además, se aplica con éxito tras operaciones de CaM a partir del día siguiente a la intervención. El objetivo del tratamiento consiste en descongestionar, reducir el dolor y favorecer la movilidad y la curación de heridas, así como mejorar la cicatrización y acelerar la reparación del tejido.
Esquema de un programa de rehabilitación fisioterapéutico para el abordaje de alteraciones funcionales del complejo articular del hombro por efectos secundarios a tratamientos oncológicos en cáncer de mama
La intervención fisioterapéutica en mujeres que sufren alteraciones de la funcionabilidad del CAH por disminución del ROM a causa del CaM surge a partir de la necesidad de brindar a estas mujeres una opción de tratamiento no farmacológico y eficaz mediante el abordaje fisioterapéutico. Las recomendaciones de dicho programa no necesariamente se deben seguir en el orden presentado ni limitarse únicamente a las técnicas mencionadas, sino que se pretende que el profesional a cargo de la rehabilitación utilice este documento como base para analizar y evaluar el proceso oncológico de la persona por atender, y así pueda elaborar una intervención individualizada y oportuna según el criterio profesional y las características individuales de la persona a tratar. Para elaborar la propuesta, se toma además de las teorías anteriormente expuestas, y recomendaciones encontrados en las referencias bibliográficas33-81. Basándose en expuesto anteriormente, se muestra el cuadro 1, en el cual se observan las técnicas fisioterapéuticas a utilizar según los objetivos deseados en la intervención fisioterapéutica para la rehabilitación de las mujeres con alteración de la funcionalidad del CAH por disminución del ROM.
Esta intervención tendrá como lineamientos generales los siguientes:
- Frecuencia de las sesiones: 1 a 5 por semana (dependerá del nivel de dolor según EVA, y el nivel de las sensaciones, síntomas), con 24 horas mínimo entre la aplicación de Agentes Electrofísicos.
- Espacio entre las sesiones: un día mínimo, 8 días máximo los primeros 4 meses. De 15 a 22 días los siguientes 4 a 8 meses. Una o dos veces al año después del primer año de tratamiento.
- Duración de las Sesiones: 45 minutos a hora y media.
- Cantidad de sesiones: Cada 6 u 8 sesiones, revalorar y registrar resultados y progreso. De no ver progresos positivos, remitir a otro profesional de salud, médico, Fisiatra, Médico Físico, Psicólogo, Psico-oncólogo, otros.
- Combinación de las técnicas utilizadas en cada sesión:
1. Técnicas de liberación: Punción seca, Cyriax, Liberación miofascial, ahorro de energía, TrPs, Masaje, Oscilación Profunda.
2. Técnicas de estabilización articular: Movilizaciones, Ejercicios, Miofeedback, EMS, Kinisio Tape (preferiblemente se debe colocar al final de la sesión).
3. Técnica analgésica (Masaje, TENS, Crioterapia).
4. Educación de los ejercicios y recomendaciones para el hogar.
Conclusión
Las alteraciones NME que comprometen mayormente el ROM del CAH ipsilateral asociadas a tratamientos oncológicos son más que todo alteraciones nerviosas periféricas, capsulopatía, desequilibrios musculares y posturales. La relación entre dolor y diversas alteraciones presentes en las mujeres con CaM que alteran la ROM del CAH, es estrecha.
Estas alteraciones se generan por proceso de inflamación en los tejidos blandos cercanos al CAH asociados a tratamientos oncológicos y al cáncer. La cirugía con LA presenta limitación del CAH en rotación externa, abducción, flexión y abducción asociada con rotación externa, mientras que en BGC mantienen la limitación únicamente en los dos últimos movimientos. Los tratamientos de CaM alteran la actividad de músculos cercanos al CAH a pesar de que no se encuentran el Campoo de la cirugía y radioterapia.
El tiempo de aparición de estas alteraciones varía entre una persona y otra, y se pueden mantener por varios años posterior al tratamiento. Los movimientos restringidos son flexión y abducción del hombro. Se considera deteriorada la movilidad del CAH si existe diferencia de 25° del ROM entre el brazo sano y el afectado.
El terapeuta físico especializado en rehabilitación oncológica brinda herramientas factibles, eficaces y confiables para ayudar a mitigar efectos del cáncer y secuelas del tratamiento oncológico en las alteraciones funcionales del CAH que limiten la ROM.
Los AF se utilizan para reducir dolor y facilitar la cicatrización de tejidos en procesos oncológicos. La regla general en AF es la contraindicación local sobre zonas de sospecha o diagnóstico confirmado de malignidad y/o metástasis36,71,82,83. Se debe considerar, además, las demás contraindicaciones y precauciones de las demás comorbilidades que pueda presentar tal como, úlceras, tejido irradiado, lesiones en la piel, problemas de coagulación, presencia de dispositivos eléctricos, implantes metálicos, hipertensión, otros. La aplicación de estos agentes requiere análisis del efecto fisiológico en los tejidos y sobre el cáncer y se deben utilizar con precaución.
|
Técnica |
Objetivo |
Abordaje |
Dosificación |
|
Técnicas de liberación |
Trabajar adherencias tanto de la cicatriz como del CAH. |
Masaje transversal de tejido profundo (Cyriax) |
1 a 3 minutos, inclusive 10 minutos, con el super dedo (unión del segundo y tercer dedo), movimientos en dirección transversal a la cicatriz, esta debe estar cerrada y libre de drenajes. |
|
Reducir tensión muscular.
|
Inducción miofascial |
Aplicar intervenciones miofasciales mediante técnicas superficiales o directas (deslizamientos en J, longitudinal, trasversal) y técnicas profundas (manos cruzadas) dirigidas a los músculos de la pared torácica y del CAH. |
|
|
Prevenir y abordar las restricciones de la movilidad del CAH.
Abordar otras causas posibles de la limitación (síndrome de la Red Axilar, TrPs tanto activos como latentes, contracturas, retracciones miofasciales). |
Técnicas de Ahorro de energía |
Aplicar intervenciones de liberación de energía dirigidas a los músculos de la pared torácica y del CAH. -Relajación Post Isométrica (PIR): Método de Karel Lewit: realizar una suave elongación del músculo hasta la barrera antes de la aparición de dolor. La persona debe realizar suave contracción isométrica en contra del terapeuta (10% - 20%) y debe mantenerla por 5 a 10 segundos. Al relajar debe respirar y se lleva a una nueva barrera (sin estirar). Realizar de 3 a 5 Repeticiones. Nota: Se puede solicitar contracción del músculo antagonista. Como se implica la cabeza, cuello o tronco se solicita a la persona dirigir la mirada en la dirección de la contracción, como hacia la dirección de estiramiento durante la fase de estiramiento. Método Vladimir Janda: Llevar el músculo a una posición intermedia entre el estado de estiramiento completo y el de relajación completa. La persona debe realizar una contracción isométrica empleando un esfuerzo máximo (100%) y mantenerla por 5 a 10 segundos. Al liberar el esfuerzo, se realiza un ESTIRAMIENTO RÁPIDO hasta la nueva barrera (se mantiene durante al menos 10 segundos). La persona se relaja durante aproximadamente 20 segundos. Se repite el procedimiento de 3 a 5 veces. |
|
|
|
Estimulación puntos gatillo (TrPs) |
Encontrar los TrPs en músculos del cuello y del CAH (músculo Pectoral Mayor, Infraespinoso Trapecio, Serrato, Redondo menor) Utilizar alguna de las siguientes técnicas: -Inhibición Isquémica: Comprimir el TrPs hasta generar dolor, mantener la compresión hasta que el dolor baje a 2 EVA, aumentar la presión y mantener hasta que el dolor vuelva a bajar, repetir una tercera vez, solicitar una respiración profunda y soltar la presión. -Técnica de Jones: presionar hasta producir una percepción de dolor de 5 – 7 en la escala EVA. Movilizar alguna articulación cercana buscando una posición donde la sensibilidad disminuya hasta cero, se mantiene tanto la posición como la presión durante 90 segundos y liberar. -TINI (Técnica Inhibitoria Neuromuscular Integrada): Palpar el TrPs, realizar una liberación posicional, ejecutar una técnica de Energía muscular, elongar el musculo trabajado, realizar una liberación posicional. |
|
|
|
Masaje Terapéutico |
Realizar en zonas tensas effleurage, petrissage, fricciones, compresiones, amasamiento digital, estiramientos pasivos, asistidos, percusiones, movimientos circulares con dedos centrífugamente, entre otros movimientos. De 10 a 20 minutos
Ninguna de las técnicas anteriores se debe realizar directamente en la zona del tumor primario si aún el cáncer se encuentra activo. |
|
|
|
Punción seca |
Seleccionar el tamaño guja y posición tanto de la persona como del terapeuta más adecuadas para el musculo a trabajar. Buscar el TrPs y localizarlo y limpiar la zona. Seleccionar el tipo de agarre acorde al musculo. Seleccionar la Técnica. -Técnica de Entrada y Salidas Rápida de Hong: Insertar la aguja en el músculo y se realiza una entrada y salida sin llegar a sacar la aguja de la zona, buscando la respuesta de espasmo local unas 5 a 7 veces. -Técnica superficial de Baldry: introducir la aguja en los tejidos subcutáneos suprayacentes al TrPs durante un corto periodo de tiempo preguntar si el dolor bajo y retirar la aguja. Si el dolor no disminuye, se puede manipular con suavidad la aguja y dejarla de nuevo por unos 30 a 60segundos. -Técnica de giros de agua: Introducir la aguja sin que pase esta de la fascia (tejido superficial) y girarla primero hacia u sentido hasta sentir una barrera o general dolor, y luego repetir haca el otro lado. Volver al punto de partida y retirar la aguja. Tras la punción se pueden realizar técnicas de terapia manual y siempre debe hacerse una reeducación de la musculatura mediante técnicas de estiramiento, lo más recomendable son estiramientos excéntricos. No se recomienda en una sesión realizar punción en más de 5 puntos. Se debe esperar 8 días para una nueva punción seca en la misma zona. |
|
|
Crio- terapia |
Disminuir el dolor. |
Criomasaje |
10 minutos. -Aplicar un masaje de forma circular con un hielo en cubito, o Ice-Rolling, directamente en TrPs o en una zona álgica no mayor a 15cm2. -Colocar una compresa fría envuelta en un paño húmedo, además se puede colocar aceite neutro o de almendra (nunca mineral) para proteger la piel. Se le debe decir a la persona que sentirá: frío, quemazón, ligero dolor y entumecimiento o insensibilidad, al llegar a este punto, se detiene la aplicación. |
|
Electro-terapia |
Disminuir el dolor. |
TENS convencional |
De 15ª 60 minutos. Intensidad a tolerancia de la persona. Localización: zona dolorosa (hombro). Frecuencia: 70-150Hz. Ancho de pulso: 180- 280us. Electrodos: carbón o adhesivos (precaución con estado de la piel). |
|
Estirar o relajar músculos tónicos |
|
De 20 a 60 minutos. Intensidad a tolerancia de la persona. Localización: musculo tónico por trabajar. Frecuencia: 20 Hz. Ancho de pulso: 220us. Electrodos: adhesivos/ de lápiz. Aplicar la técnica de preferencia según criterio profesional: Técnica de electro elongación / Técnica de Golgi. Nota: Considerar presencia de marcapasos. |
|
|
Oscilación Profunda |
Disminuir el dolor. Lograr la relajación Muscular. Mitigar la Fibrosis. Aumentar la movilidad del CAH |
|
La zona a tratar debe estar limpia. La persona debe sostener la barra de titanio, el terapeuta deberá utilizar guantes finos de vinilo y colocar un electrodo en el brazo. Tanto el electrodo como la barra están conectados a la máquina, también el terapeuta puede sujetar el del aplicador manual, que es sometido a movimientos rotativos sobre el tejido.
Elegir los parámetros según objetivos (el equipo posee programas ya establecidos según la patología que se desea tratar). |
|
Kinésio Tape |
Corregir postura (Síndrome Cruzado Superior). |
Técnica corrección postural. |
La herida debe estar cerrada. Dos tiras en I. Aplicación: Base en Clavícula, posición erguida, cuerpo del tape del 50% al 75% de tensión en dirección a la cintura Contraria. Las dos tiras se deben cruzar en la zona de máxima curva. Se debe realizar una X en la zona de la espalda para corregir postura. |
|
Mejorar la movilidad del CAH en caso de capsulitas. |
Técnica para Hombro Congelado |
Cuatro tiras en Y, una tira en I. Aplicación: se puede observar un ejemplo de esta ampliación en el siguiente link: |
|
|
Cinesisterapia |
Recuperar la Movilidad Articular del CAH. |
Movilizaciones
|
Se pueden realizar movilizaciones pasivas en los primeros días del tratamiento, respetando las barreras de dolor y anatómicas. Se busca recuperar los movimientos mayormente afectados (flexión y abducción del hombro) sin dejar de lado el ritmo escapulohumeral y los demás movimientos. |
|
Biofedback / EMS |
Programar el equipo según la elección del estímulo (biofedback o EMS) abordar los grupos musculares mayormente afectados (aquellos encargados de la flexión y abducción del hombro). No se recomienda trabajar más de tres grupos musculares o movimientos del CAH para evitar la fatiga y sobrecarga muscular. |
||
|
Ejercicio Terapéutico. |
Realizar un plan de ejercicio terapéutico que incluya fortalecimiento muscular (enfocado en miembro superior para recuperar el ROM), resistencia aeróbica, equilibrio, estiramiento y propiocepción según las disposiciones de American Colege of Sports Medicine. No se debe realizar ejercicio físico si: La saturación de oxígeno es menor a 84, o la hemoglobina es menor a 10 g/dL, trombocitopenia (plaquetas -20.000/mm3) Si presenta fatiga 7/10, 24 horas después de Quimio. Mareos, dolor de pecho, nausea, metástasis óseas, fiebre, infección activa, comorbilidades no compensadas, limitaciones asociadas a efectos secundarios
Siempre tener a la vista la Escala de BORG y controlar variables fisiológicas. |
Cuadro1. Técnicas Fisioterapéuticas para la intervención de la alteración de la funcionalidad del complejo articular del hombro (CAH) por disminución del ROM en mujeres con cáncer de mama.
Fuente: Elaboración del autor basada en las referencias 33-83.
Referencias Bibliográficas