Introduction: In breast cancer is one of the most frequent in women, it brings with it several complications after treatment. one of them is painful ghost breast syndrome (PGBS), which is the subjective experience of perceiving and detecting the presence of all or part of the breast accompanied by pain. In Costa Rica, there is no protocol or guide for the physiotherapeutic approach in women with PPBS. Objective: To establish the pathophysiological characteristics of the PPBS to achieve its understanding and thus prepare a proposal for physiotherapeutic intervention based on the effects of physical agents on the body. Materials and methods: Descriptive study of bibliographic review, considering digital resources such as PubMed, LILACS, Scielo, Elsevier, RefSeek, Google Scholar, Dialnet, Academia, Base, Springer Link, ERIC and Redalyc as sources, using the words neoplasm of breast AND mastectomy OR syndrome of ghost limb OR pain AND physiotherapy OR rehabilitation. Documents published from 1990 to 2020 are included, in Spanish, English and Portuguese. Based on the published evidence, physiotherapeutic intervention algorithms are proposed in women with PPBS. Results: A physiotherapeutic intervention proposal for PGBS is elaborated, based on the theories found that show the cause, symptoms and signs of the syndrome. Physiotherapeutic modalities are established with evidence and scientific support that can be safely used under professional judgment and knowledge to address PGBS or similar syndromes such as phantom pain. TENS, superficial thermotherapy and cryotherapy are established as physiotherapeutic techniques to treat pain; in addition some manual techniques such as Trigger Point Release, therapeutic massage and neurodynamics to treat myofascial and nervous tissue affected by the surgery; in addition to the use of neuromuscular bandage to improve the affected mechano-sensitivity in women with this GPBS. Conclusion: Physiotherapists with knowledge in oncological rehabilitation can generate great contributions in the health and quality of life of women with GPBS, using physiotherapy based in evidence.
KEY WORDS: breast neoplasm, mastectomy, syndrome of phantom limb, surgery, postoperative pain, physiotherapy, rehabilitation.
Introducción
El cáncer de mama (CaM) es uno de los más frecuentes a nivel mundial en mujeres. Según el Globocan1 el 25% de las mujeres padece de CaM en el mundo, el 14% muere a causa del cáncer. Las estadísticas en Costa Rica son semejantes, el 26% de las costarricenses padece CaM, y el 74% sobreviven. La tasa de supervivencia general del CaM durante el periodo comprendido del año 2000 al 2003, es de 91,7% al primer año y de 71,5% a los cinco años de seguimiento2. Las mujeres que vencen el CaM, deben luchar no solo contra secuelas de enfermedad, sino también, contra los efectos secundarios a tratamientos oncológicos y entre ellos se encuentran, las complicaciones post operatorias (CPO). Con el propósito de ilustrar de mejor manera las CPO se presenta la Figura 1.
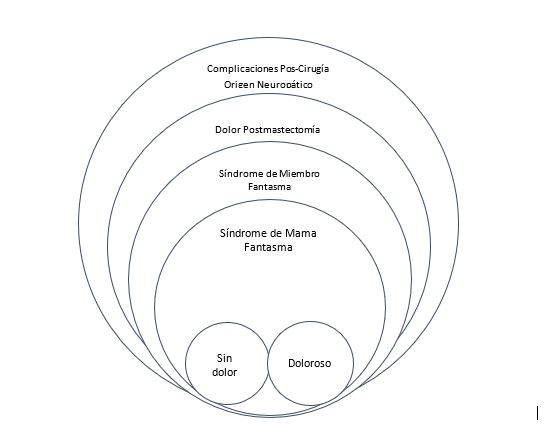
Figura 1: Origen del Síndrome de Mama Fantasma Doloroso
Dentro de las CPO se encuentra el dolor post mastectomía. Este es un síndrome de dolor crónico más allá del periodo “normal” después del proceso quirúrgico causado por el daño sufrido por nervios periféricos durante la cirugía3. Es un dolor neuropático típico (quemazón, dolor punzante, sensación eléctrica), suele ser provocado por la presión o espontáneamente4. El dolor post mastectomía es uno de los efectos secundarios más comunes, y dentro de esta categoría se incluyen los síndromes de miembro fantasma (MF) tanto doloroso como no doloroso5.
Los síndromes de MF dolorosos (MFD) se manifiestan como una sensación dolorosa de la parte distal a la región en que se encontraba previamente la extremidad, o en que se encuentra el muñón posterior a la amputación6. Las mujeres mastectomizadas no quedan exentas de estos síndromes, ya que ellas pueden presentar el síndrome de mama fantasma (SMF) tanto no doloroso como doloroso. El primero, comprende un conjunto de síntomas en mujeres mastectomizadas que describe a todas aquellas sensaciones que una mujer refiere como “si la todavía tuviese la mama”, se define como una experiencia subjetiva de percibir y detectar la presencia de toda la mama, parte de esta o solo el pezón, de forma característica, la experiencia fantasma de la mama posee el tamaño, forma y/o peso del seno normal7 y se puede presentar sensaciones de persistencia, peso, prurito picazón, hormigueo, o/y ardor en el seno extirpado8.
También, se define como una experiencia subjetiva de percibir y detectar la presencia de toda la mama, parte de esta o solo el pezón después de la ablación por mastectomía acompañado con dolor9. La aparición del SdMFD se da generalmente durante los tres primeros meses tras la mastectomía, aunque puede ocurrir incluso al año10.
El mecanismo de desarrollo de este síndrome no se conoce con exactitud, aunque parece ser que la lesión de nervios axilares y de los nervios de la pared torácica anterior, daría lugar a un dolor de tipo neuropático11. Otros autores han propuesto como explicación la neuralgia intercostobraquial12, así como los neuromas intercostales, mientras que Frontera et al13 mencionan además la lesión de los nervios pectoral medial y pectoral lateral durante la cirugía.
La frecuencia del SdMFD varía del 7% al 17,4%10 de las pacientes mastectomizadas. En los reportes de bajo porcentaje las razones podrían ser: el escaso conocimiento del SdMFD, que lleva a los profesionales a desvalorizar el hallazgo; la inhibición de las mujeres en describir el SdMFD por temor a ser clasificadas con algún desorden mental y el desconocimiento del SdMFD que tienen las mismas mujeres mastectomizadas14.
Durante la revisión bibliográfica no se encuentra recomendaciones establecidas ni aprobadas por las instituciones de salud nacionales, que establezcan una guía en el proceder fisioterapéutico ante el SdMFD. Por ello, se realiza la presente investigación, que busca elaborar una propuesta de intervención fisioterapéutica para el SdMFD en mujeres mastectomizadas, caracterizando sus principales síntomas y analizando las intervenciones fisioterapéuticas que pueden ser eficaces para el abordaje del SdMFD.
Metodología
Se realiza un estudio de revisión bibliográfica de tipo cualitativo observacional. Se incluyen estudios de casos, metaanálisis, revisiones bibliográficas, libros, artículos en revisión y tesis, publicados en inglés, español y portugués entre 1999 y 2020, no obstante, se consideran documentos publicados antes de 1990 por relevancia de antigüedad. Se utilizan los buscadores: PubMed, LILACS, Scielo, Elseiver, RefSeek, Google Académico, Dialnet, Academia, Base, Springer Link, ERIC y Redalyc, además se consultan libros sobre agentes físicos aplicados a terapia, considerando como descriptores las palabras neoplasia de la mama OR mastectomía OR miembro fantasma OR cirugía OR dolor AND fisioterapia OR rehabilitación.
Se obtiene de la búsqueda un total de 239 documentos, los mismos se seleccionas de acuerdo a su título, resumen y consideraciones finales con el propósito de valorar la calidad y pertinencia con el tema, descartando 15 documentos duplicados y 100 por criterios de exclusión (estudios con población meta diferente a mujeres con mastectomía radical simple o modificada; antigüedad de publicación mayor a 30 años; diferenciación poco clara entre dolor postmastectomía, miembro fantasma, síndrome de mama fantasma doloroso - no doloroso).
Se leen 124 documentos a cabalidad, descartando 75 debido a los criterios de exclusión. En la figura 2, se puede observar el algoritmo de búsqueda, selección y extracción de la información, además del nivel de evidencia según Sackett15 aplicado a los documentos relacionados a tratamiento fisioterapéutico en miembro fantasma. Se destaca que no se encontró un documento específico de suficiente peso de evidencia científica sobre el abordaje fisioterapéutico en el SdMFD.

Figura 2. Algoritmo de búsqueda, selección y extracción de la información
Discusión de resultados
Se incluyen para los resultados un total de 53 documentos; la figura1 detalla el flujo de búsqueda, selección y extracción de la información. De acuerdo con los niveles de evidencia según Sackett15, los artículos incluidos que se refieren a tratamientos terapéuticos del miembro fantasma doloroso fueron: 22 documentos de nivel 1, 5 documentos de nivel 2, un documento de nivel 3; un documento de nivel 4. Además, se incluyeron cuatro libros. Estos documentos desarrollan temas sobre el tratamiento fisioterapéutico en el MFD y en el dolor de origen neuropático y el uso seguro de agentes físicos. No se encontró documentos relacionados con el abordaje fisioterapéutico en el SdMFD específico. Así mismo, se deben considerar otras características del SdMFD para poder comprenderlo a cabalidad y lograr establecer una propuesta de abordaje fisioterapéutico. Estas se mencionan seguidamente:
1.Factores de riesgo: Dentro de los factores de riesgo asociados a la aparición de SdMFD están:
- Tipo de cáncer: el CaM in situ, específicamente carcinoma ductal in situ se asocia con mayor frecuencia al SdMFD, en comparación con tumores invasivos7. Se cree que al ser pre invasivo y que crece linealmente a través de los conductos sin invadir el sótano membrana16, no puede modificar la entrada neural de la región del seno7.
- Radioterapia: el SdMFD se manifiesta como exacerbación aguda de dolor crónico, a menudo relacionada al posicionamiento para el tratamiento, quemaduras, neuropatía o mielopatía17 relacionados con la radioterapia.
- Quimioterapia: el SdMFD está asociado a la polineuropatía periférica, mucositis por leucopenia o necrosis aséptica18 secundarias a la quimioterapia.
- Depresión (mujeres jóvenes): la Teoría de Neuromatriz de Melzack19, propone que, la conciencia consciente y la percepción del cuerpo y del yo (y, por tanto, de las miembros fantasmas), se genera a través de patrones de actividad neuronal que se pueden activar o modular mediante diversas entradas perceptivas ascendentes, o por procesos emocionales y cognitivos descendentes. Múltiples señales sensoriales, son integradas y modulados por la experiencia individual, proporcionando información sobre el cuerpo y las sensaciones, formando el sustrato de construcción de uno mismo. Diversos mecanismos interactúan entre la depresión y el SdMFD, generando conflicto dentro de la neuromatriz que contiene toda la información sobre un cuerpo intacto que no se puede actualizar debido a sus conexiones genéticamente determinadas20.
- Mujeres jóvenes mastectomizadas: las mujeres mayores a 66 años son menos propensas a desarrollar la SdMFD en comparación con aquellas con edad inferior a 51 años21. Las mujeres más jóvenes sienten más el impacto de la enfermedad y del tratamiento en comparación con las mayores. Tal asociación ocurre por el hecho de que la mama representa un símbolo de feminidad. La imagen corporal alterada después de la mastectomía, la relación con el ciclo menstrual, la mayor agresividad del cáncer y mayor fragilidad emocional en el preoperatorio, interfieren en la calidad de vida global, salud general, función física y social de la mujer16.
- Mayor escolaridad: las mujeres con más años de estudio presentaron mayor riesgo de presentar la SdMFD22. Una explicación a este fenómeno sería el hecho de que la población de la mayoría de los estudios realizados está constituida por mujeres jóvenes, tendiendo a aumentar la posibilidad de presentar una mayor escolaridad.
2.Factores predisponentes: otros factores predisponentes son21: cirugía en sí (debido a la alteración de las vías nerviosas del dolor tras ser cortados los nervios de del seno durante cirugía), afectación del nervio intercostobraquial, tipo de cirugía (más que todo, mastectomía radical), compromiso axilar (necesidad retirar mayor número de ganglios linfáticos). Debido a que el SdMFD es una condición psicosomática (de las interrelaciones de la mente y el cuerpo o relacionado con ellas), los factores físicos pueden afectar tanto el curso como la severidad del SdMFD. Entre dichos factores se pueden citar: el ejercicio; tacto; movimiento del miembro superior homolateral; condiciones psicológicas; cambios climáticos pueden ser considerados factores inductores o de alivio)23.
3.Sensaciones, síntomas y signos: según Katz et al24, las sensaciones, síntomas y zonas donde son percibidas por parte de las mujeres que lo padecen se clasifican en cuatro tipos distintos:
a. Parestesias (más comunes): hormigueo, escozor, clavos y agujas, entumecimiento, shock eléctrico.
b. Aumento en la intensidad del dolor de forma aguda o retardada; puede ser mínimo, molestia o severo; continuo o con frecuentes exacerbaciones.
c. Cambios en la percepción de la temperatura en alguna parte del cuerpo.
d. Sensación de presión o constricción.
4. Sensaciones percibidas por mujeres: las sensaciones reportadas por las mujeres con SdMFD incluyen: ardor, aplastamiento, dolor fulgurante, calambres, presión, sensación punzante o quemante, sensación de triturar la extremidad, desgarro, torsión, mordisco, como sensación de serrar el miembro, como un latigazo, como una cornada, hormigueos o parecerse a un golpe eléctrico, como si agua hirviendo fuera derramada sobre su miembro, si el miembro está ardiendo o se encuentra en una posición anormal dolorosa25.
5. Localización anatómica de la sensación: en cuanto a la localización de la sensación fantasma (sea dolorosa o no) los fenómenos se localizan principalmente en todo el seno y con menor frecuencia en el pezón7. Esto difiere de las extremidades fantasmas, en donde las partes periféricas de una extremidad amputada son las más vívidas26.
Técnicas fisioterapéuticas para el SdMFD
La evidencia científica publicada sobre el abordaje fisioterapéutico en SdMFD es escasa, por ende, se toman en consideración las publicaciones sobre el tratamiento fisioterapéutico el MFD. Lo anterior se justifica debido a que el SdMFD se encuentra dentro de los MFD, y según García Lafuente et al 27, en su estudio publicado en el 2019 cuyo objetivo principal es conocer la efectividad de los tratamientos de fisioterapia en el manejo de MFD, evidencia resultados positivos en cuanto a la disminución de la intensidad de dolor tras la intervención fisioterapéutica, concluyendo así que, los tratamientos de fisioterapia parecen ser efectivos en la disminución de la intensidad de dolor de MFD en la mayoría de los sujetos amputados.
Por otro lado, el SdMFD presenta una alteración de las vías nerviosas del dolor tras ser cortados los nervios de del seno durante cirugía, típico del dolor de origen neuropático, por lo que se consideran, además, las pautas fisioterapéuticas utilizadas para el abordaje de este tipo de dolor. El tratado de Dolor Neuropático menciona entre el uso del TENS (estimulación eléctrica transcutánea), las terapias manuales (TM), la magnetoterapia y otras terapias alternativas, para el tratamiento de este dolor, aunque menciona también que, no se cuenta con un nivel de evidencia suficiente que permita su total recomendación. No obstante, dicho tratado establece que la terapia física debe formar parte habitual del tratamiento en las lesiones de dolor neuropático28.
Además, se consideran otros aspectos como el efecto fisiológico de los agentes físicos, la explicación teórica del porqué se podría aplicar en SdMFD, las contraindicaciones generales de cada una de las aplicaciones y la aplicación de agentes fisioterapéuticos en el MFD y dolor neuropático. De esta forma, se establecen posibles métodos de Intervención fisioterapéuticas para el SdMFD, no obstante, se recomienda a cada fisioterapeuta el uso de su ética y conocimiento científico para aplicar estas u otras técnicas.
Es de suma importancia la educación de la persona por tratar sobre el tema, las posibles complicaciones, riesgos, beneficios, sensaciones y otras consideraciones del tratamiento fisioterapéutico. Se recomienda el uso de un consentimiento informado.
Dentro de los tratamientos mencionados por la bibliografía consultada para el MFD se encuentran el TENS, la terapia electroconvulsiva (TEC), la terapia del espejo, la desensibilización, la acupuntura, la estimulación cerebral profunda y de la médula espinal, entre otras29. Según el tratado de dolor neuropático el TENS, las terapia manuales, la magnetoterapia y otras terapias alternativas, se pueden utilizar para el manejo de este tipo de dolor, aunque no se cuenta con un nivel de evidencia suficiente que permita su total recomendación de algunas de estas30, debido a lo anterior se consideran como posibles modalidades fisioterapéuticas estos agentes para la intervención del SdMFD.
Se encuentra en las referencias diversas técnicas de electroestimulación con resultado útiles en el tratamiento del dolor del MF, por ejemplo, la estimulación del muñón, el electro-sueño, la estimulación de nervios periféricos, la contra-estimulación, destacando entre ellos la TENS, la cual se explicará con más detalle a continuación.
TENS (Estimulación Eléctrica Transcutánea)
Esta técnica consiste en un generador portátil de corrientes eléctricas que atraviesan la superficie intacta de la piel y activan fibras nerviosas. Su acción depende del tipo de fibras estimuladas, ya que si estimula fibras A de diámetro grande produce analgesia segmentaria (convencional), y si estimula fibras A de diámetro pequeño produce analgesia extra segmentaria31.
El mecanismo analgésico del TENS se basa en la teoría de la puerta de control de Melzack y Wallm, en el incremento de los niveles de endorfinas que siguen a la estimulación eléctrica y en la hipótesis de que los impulsos eléctricos pueden romper los “circuitos de la memoria dolorosa”31. Lo anterior es de importancia ya que al poseer el cerebro humano la capacidad de recordar el dolor pre-amputación, aunque los estímulos nocivos periféricos hayan sido eliminados durante la cirugía, el TENS puede romper estos circuitos de memoria álgica en el MFD y se podría extrapolar más directamente al SdMFD.
El TENS se puede utilizar de manera eficaz en el MFD de tres maneras diferentes, directamente en el muñón, sobre nervios periféricos y la contraestimulación. Al aplicar TENS en la extremidad contralateral a la amputación, este desciende la intensidad y sensación dolorosa (debido al efecto de la estimulación de la extremidad contralateral en las células de la médula espinal que produce la sensación fantasma) facilitando el control inhibidor y consecuentemente, la disminución o eliminación del MF32, además, es posible, que esta corriente aplicada a la extremidad contralateral, origine una reducción inicial en la actividad sudomotora simpática en el muñón y en el tejido circundante, disminuye primariamente las aferencias y origina una reducción de las sensaciones fantasmas33. En un reporte de caso realizado por Frontera et al34, en el 2010 se encontró que la estimulación con TENS en la extremidad sana sobre la región donde se experimenta dolor fue significativamente mejor que el placebo al reducir la sensación fantasma. Por otro lado, se cree que al ser aplicada esta corriente en el muñón puede exagerar la pérdida gradual del miembro fantasma, o bien revivir una sensación suprimida33.
Una revisión Cochrane correspondiente a un metaanálisis realizado por Mulvey et al35, en el 2010, el cual evalúa la efectividad analgésica del TENS en el tratamiento del MFD y dolor del muñón en adultos amputados, muestra que no existe ningún estudio clínico aleatorizado que examine la efectividad de esta terapia el MFD. Posteriormente en el 2013, el mismo autor, realiza otro estudio con un pequeño número de sujetos con MFD (10 sujetos en total), en donde se evalúa el efecto de la TENS con una dosis diaria de 30 a 60 minutos, entre los hallazgos encontrados se destaca la disminución del dolor según una escala numérica de calificación, el dolor se redujo en 1,8 ± 1,6 en reposo (p < 0,05) y 3,9 ± 1,9 en movimiento a los 60min de la terapia (p < 0,05), y concluyendo que el TENS posee potencial para reducir el DMF durante el reposo y movimiento36.
Un estudio piloto de tipo experimental longitudinal comparativo en un grupo de 44 sujetos amputados del miembro inferior con dolor en el MF, realizado por Álvarez et al37 en el 2015, se evalúa el dolor de miembro fantasma mediante la escala visual analógica (EVA), al tercer día post-amputación, durante la etapa hospitalaria se les aplica a los sujetos TENS convencional, para finalmente reevaluar el dolor con la misma escala EVA después de 14 días de tratamiento. Los resultados evidencian una disminución del dolor en el MF, cuando se aplica la corriente TENS convencional, demostrando así que el TENS puede ser eficaz para aliviar el MFD inferior durante la etapa pre-ambulatoria.
Dedo que el TENS parece ser beneficioso en el MFD, se podría considerar su uso para el tratamiento del SdMFD ya que es una técnica económica, simple y segura, se puede utilizar durante mucho tiempo con pocos riesgos y efectos adversos y por su acción de bloqueo de las memorias dolorosas del cerebro en miembros afectados.
Contraindicaciones: se debe mantener precaución y omitir su uso directamente sobre la zona pectoral en caso de marcapasos o algún problema cardiaco descompensado, en trastornos de la sensibilidad o sobre herida abierta.
Terapia manual (TM)
Se ha mencionado que la TM podría ser dañina para la persona con cáncer. El riesgo más grande al que se le teme es de metástasis al dar TM sobre o en las inmediaciones de un tumor38. No obstante, la metástasis no es un proceso mecánico que se pueda influir por estímulos manuales; este es un proceso complejo en el que están involucrados factores como los genes39. Sin embargo, no se recomienda su aplicación de manera local o directamente sobre el cáncer activo.
Las técnicas manuales que vayan destinadas al despegamiento cicatricial y a reducir la tensión muscular se podrían utilizar en el SdMFD, ya que está demostrado que la estimulación táctil del muñón (o zona donde estuvo el miembro antes de la operación, en este caso) reduce la aparición de miembro fantasma40. Sin embargo, dado a la escasa evidencia científica que demuestre la eficacia real de esta técnica y sus diversas derivaciones en el SdMFD, y en el MFD en general, se mencionan a grandes rasgos los beneficios de dichas manipulaciones que se podrían obtener en estas patologías.
- Masaje terapéutico: busca disminuir el dolor, contracturas, adherencias. Se aplican técnicas como effleurage, petrissage, fricciones, compresiones, amasamiento digital, estiramientos pasivos, asistidos, percusiones, presiones, movimientos circulares con dedos centrifugamente, entre otros movimientos. Además, no existe evidencia que el masaje pueda extender el cáncer, aunque no se debe realizar presión sobre el tumor41, el masaje en zonas aledañas ayuda a reducir el dolor, la ansiedad, de los efectos adversos de la quimioterapia y, brinda efectos analgésicos42.
- Liberación miofascial: es una modalidad específica del masaje basada en la manipulación del tejido miofascial para tratar alteraciones funcionales. Algunos estudios han demostrado que la aplicación de técnicas de liberación miofascial, proporciona efectos de hipoalgesia en diferentes condiciones43. Crawford et al44 demuestra que ciertas intervenciones miofasciales dirigidas a los músculos de la pared torácica, proporciona un alivio después de la tumorectomía y la radiación sobre el pecho en mujeres con CaM. Es posible que las técnicas miofasciales puedan disminuir la hipersensibilidad del dolor a la presión en supervivientes de CaM, no obstante, no se han publicado revisiones bibliográficas que validen esta hipótesis, tampoco se encontraron estudios con suficiente peso científico que evidencie los resultados de la liberación miofascial con el SdMFD.
- Estimulación de puntos gatillos: el dolor, es uno de los síntomas principales que sufren las mujeres tras la cirugía de mama, y una de las causas de este dolor son los puntos de tensión, llamados puntos gatillo o trigger points (TrPs por sus siglas en el idioma inglés), especialmente en músculos del cuello y del hombro45. Existe evidencia científica que sugiere otros factores contribuyentes, por ejemplo, la disfunción del tejido miofascial46, se puede concluir que los TrPs poseen un roll importante en este tipo de dolores, recordando que tanto el MFD y específicamente el SdMFD son parte de las complicaciones y/o dolores Postmastectomía. Hamada et al47 en su estudio documenta 27 casos de mujeres con dolor pos-toracomía evidenciando que, en el 67% de estas mujeres la principal fuente de dolor posee un origen miofascial, este hallazgo concuerda con un estudio de cohorte de 163 mujeres con CaM el cual muestra que el 21% de estos presentan dolor de origen miofascial48. Cummings49 en una descripción de caso, menciona que los principales TrPs activados a consecuencia de traumatismo posterior a cirugía transaxilar son los del músculo pectoral. Por su parte Fernández et al45, menciona que el estimular los TrPs del cuello, hombro y axila podría estimular la zona pectoral y lograr algesia por estimulación referida o periférica, esto debido a que los TrPs ubicados en los músculos pectoral mayor, infraespinoso y trapecio superior son más prevalentes ipsilateral en mujeres mastectomizadas. La incorporación de programas de fisioterapia para inhibición de los TrPs puede ser beneficiosa para reducir el dolor y prevenir restricciones de la movilidad del hombro en el dolor MFD50 pudiendo haber beneficios también en el SdMFD, así mismo, las estrategias basadas en la mejora de la movilidad y resistencia muscular, así como el tratamiento mediante los TrPs podrían reducir el uso de fármacos que son utilizados para el manejo de la sensibilización central que sufren las personas con dolor post mastectomí
- Neurodinámica: es una técnica de movilización manual que consiste en la movilización pasiva, estiramiento y deslizamiento de los nervios durante su recorrido con la finalidad de liberarlo en los posibles atrapamientos que desencadenan la sintomatología para aliviar, incluso eliminar, algunos tipos de dolores que tienen su origen en alteraciones o problemas del nervio periférico. Las mujeres que han sobrevivido a CaM presentan una mecanosensibilidad elevada, y al evaluar la respuesta a la presión y los test neurodinámicos del miembro superior, la respuesta de dolor es elevada a la presión de los troncos nerviosos, y un recorrido más corto en los movimientos correspondientes a las pruebas neurodinámicas51. Esto se debe a que a las mujeres con CaM son sometidas a diferentes procedimientos que modifican sustancialmente la mecánica local de la cintura escapular, tórax y zona cervical sumado irritaciones del plexo braquial de la radioterapia y cirugía52. Un estudio descriptivo realizado por Rosa53 en el 2017, realiza un test neurodinámico ULT1 para el nervio mediano, así como una maniobra de sensibilización neural para determinar si el test era positivo a 125 mujeres con CaM intervenidas con linfadenectomía o biopsia del ganglio centinela. Los resultados de dicho estudio revelan que el tejido neural está implicado en los síntomas de las mujeres tratadas de cáncer de mama y la mecanosensibilidad neural del plexo braquial está incrementada. Las técnicas neurodinámicas cambian las capacidades físicas del sistema nervioso por el uso de movimientos multiarticulares que alteran la longitud y forma del lecho neural alrededor de las estructuras neurales que le corresponden54. Considerando que una posible explicación del origen de SdMFD se base en la lesión del nervio axilar, del nervio pectoral medial, del nervio pectoral lateral, de los nervios de la pared torácica anterior y de los nervios intercostales, y, además, al ser el sistema nervioso un continuo, se puede deducir que al movilizar un segmento cercano (plexo braquial), de alguna manera se podría influir sobre los nervios lesionados, obteniendo una posible disminución de la sintomatología. Esto es solamente una teoría, la cual se podría investigar con más detalle en un futuro estudio que evidencia si esta técnica es beneficiosa en el SdMFD.
- Técnicas de desensibilización: La desensibilización es un tratamiento para reducir la sensibilidad mediante la exposición de la zona a diversas texturas y presiones. Varios autores mencionan el uso de las técnicas de desensibilización en el tratamiento del dolor en la zona amputada y en DMF55,56. Esto debido a que una característica frecuente asociada a la patología post amputación, es la alteración de la sensibilidad en la zona. Flor et al57, en el 2001 menciona que las sensaciones fantasmas pueden modularse con diversas manipulaciones sobre la zona amputada. Polonio58, en el 2004, menciona algunos de los procedimientos específicos dentro de las técnicas de desensibilización utilizadas en personas que han sido amputadas, entre ellas destaca los programas de sensibilización, los cuales se aplican en los casos de sujetos con disestesias en los cuales la percepción de cualquier tipo de estímulo es procesada como una sensación dolorosa, por ello, se debe tomar medidas para prevenir posibles rechazo de la técnica; y las técnicas de jerarquización progresiva del estímulo, en esta se utilizan distintos tipos de estímulos, organizados según su intensidad para desensibilizar la zona afectada, entre ellas se pueden destacar el uso de texturas, vibraciones, presión sostenida, contenedoras con partículas para inmersión. No obstante, la evidencia de la eficacia de estas técnicas es controvertida ante la ausencia de estudios clínicos controlados y aleatorizados que avalen los efectos.
Como contraindicaciones de estas técnicas manuales se mencionan las lesiones de la piel producidas por la radioterapia, quimioterapia y/o cirugía (mastectomía, reconstrucción de la mama), malestar producido por la quimioterapia, aparición de hematoma o seroma tras la cirugía, presencia de reservorios bajo la piel para la quimioterapia, flebitis, síndrome del seno carotídeo, hipertiroidismo, erisipelas, linfangitis, inflamación post-quirúrgica. Además, las metástasis en huesos, riesgo de fractura, infecciones agudas, prohibición médica e insuficiencia cardiaca descompensada (donde pueden realizarse tratamientos de poca duración y en zonas poco extensas), heridas abiertas, fracturas, lesiones severas de la médula espinal, traumatismos de importancia, náuseas o mareos, consumo drogas (especialmente intravenosas), fiebre, infecciones dermatológicas.
Crioterapia
El frío es utilizado para el tratamiento del dolor en afecciones musculoesqueléticas, tanto en lesiones traumáticas recientes como en inflamación y contracturas musculares. Posee acción directa sobre la capa muscular arteriolar por la estimulación de los termoreceptores, posible liberación de serotonina y bradicinina, y disminución de la liberación de vasodilatadores tipo histamina y prostaglandina59. A nivel nervioso, el frío disminuye la velocidad de conducción en nervios motores y sensitivos60, además por estimulación de las fibras aferentes gruesas se produce una modulación del dolor a nivel medular según la teoría de la puerta de dolor61. La duración de los cambios en el nervio depende del tiempo de aplicación: una aplicación de cinco minutos retrasa la conducción a un cuarto de hora.
Se ha visto que, durante la fase aguda tras la amputación la movilización precoz y técnicas orientadas a la desensibilización del muñón puede disminuir el edema y el dolor y, ayudar la persona a recuperar la sensación de control corporal ante la nueva situación. Esta desensibilización se puede aplicar en la amputación de la mama en caso de presentar SdMFD, al mismo tiempo de buscar analgesia, mediante la estimulación repetida del nervio lesionado. Se ha mostrado útil en algunos sujetos al provocar una tolerancia progresiva del muñón al roce y la presión, así como un posible efecto desbridante de adherencias mediante la práctica de local (golpeteo), vibración, masaje y aplicación de crioterapia62. Ribera et al63, en el 2001, mencionan como parte del tratamiento para el dolor del muñón en persona amputada el uso de crioterapia. Alós Villacrosa64 menciona de manera breve en su libro “Amputaciones del miembro inferior en cirugía vascular”, a la termoterapia (tanto frío como calor), entre los tratamientos para abordar al dolor del muñón en personas amputadas. Si bien es cierto, la evidencia sobre el uso de crioterapia en SdMFD es escasa, se recomienda para lograr ladesensibilizaciónde la zona amputada y buscar analgesia, además de realizar investigaciones que revelen los verdaderos efectos de la aplicación de la crioterapia en SdMFD.
Las contraindicaciones para esta técnica son: alergia, urticaria o hipersensibilidad al frío, trastornos de sensibilidad en piel, diabetes, problemas vasculares, Síndrome de Ratnaud, enfermedad cardiovascular grave, hemoglobulinuria y/o enfermedades renales y viscerales.
Vendaje neuromuscular (KT)
Consiste en cintas de algodón con un adhesivo acrílico que se utilizan con la intención de tratar trastornos físicos y lesiones neuromusculoesqueléticas65. Otorga libertad de movimiento permitiendo que a través del sistema muscular se recupere la homeostasis. Para ello, las vendas tienen una elasticidad longitudinal del 130% o 140% equiparando la elasticidad de la piel. El vendaje adhiere sobre la piel, abarcando las estructuras que interesan con el fin de asistir y disminuir las tensiones que actúan sobre las estructuras lesionadas.
Esta técnica eleva la piel y aumenta el espacio subcutáneo ayudando a la reducción del dolor, de la inflamación y del linfedema (fase aguda de la fisioterapia) ayudando a disminuir la extravasación de líquidos considerablemente dependiendo los sistemas que están involucrados o en los que queramos influir66. Además, ayuda a la facilitación propioceptiva y muscular, reduce la fatiga muscular, las agujetas el edema, inhibe del dolor y mejora la recuperación y el flujo linfo-sanguíneo67. Entre los efectos por los cuales se recomendaría su aplicación en el SdMFD se encuentran:
Acción neurorrefleja: el efecto neurorreflejo parte de la relación segmental de los elementos que conforman el organismo (piel, músculo, esqueleto y vísceras). Esta relación se debe a la inervación común de un segmento por el mismo nervio espinal.
Función analgésica; el cual se da por medio del sistema de control de compuertas (Gate control system) y también por su función elevadora que favorece la circulación sanguínea y evacuación linfática, disminuyendo así, la presión sobre los nociceptores.
En el caso del SdMFD se puede utilizar la técnica para ampliar espacios con el propósito de disminuir la acción de los nociceptores mediante la liberación de espacio intersticial. También se puede aplicar sobre el nervio una tira en “I” con técnica de liberación a lo largo del dermatoma correspondiente a la zona donde la persona perciba mayor sensación de dolor fantasma en la mama, se han formulado algunas hipótesis sobre el efecto descompresivo que tendría sobre la piel y las fascias y que afectaría de forma indirecta al nervio68. Está propuesta se basa en los resultados de un caso clínico de amputación suprarrotuliana bilateral por Diabetes Mellitus, con MDF. Se coloca el KT sigue el trayecto del nervio ciático (L4-S3), utilizando la técnica para aumentar el espacio con vendaje en “I”, estiramiento de la piel sin tensión del vendaje ni los anclajes. La dirección del vendaje es desde L4 hacia caudal. Los resultados reflejan disminución de las aferencias nociceptivas en un 80%68.
Sus contraindicaciones principales son: problemas cardiacos descompensados, edema generalizado, problemas de trombosis, heridas, alergias.
Esquema de un programa de rehabilitación fisioterapéutica: propuesta para el SdMFD en mujeres mastectomizadas por cáncer de mama
La intervención fisioterapéutica para el SdMFD en mujeres mastectomizadas por CaM surge a partir de la necesidad de brindar a estas mujeres una opción de tratamiento no farmacológico mediante agentes físicos utilizados en fisioterapia, lo anterior con la finalidad de mejorar la sintomatología y rehabilitar a las mujeres que lo padecen. Así mismo, se busca dar a conocer el síndrome entre la población de fisioterapeutas y de otros profesionales de la salud, para que este deje de ser una entidad poco conocida, subdiagnosticada y con escasa evidencia sobre el abordaje fisioterapéutico.
Los pasos que se establecen en dicha propuesta, no necesariamente se deben seguir en el orden presentado, se debe analizar y evaluar a cada persona para elaborar una intervención individualizada y oportuna según el criterio profesional y las características individuales de la persona a tratar.
Para elaborar la propuesta, se toma además de las teorías anteriormente expuestas, el enunciado mencionado en El Manual de Medicina Física y Rehabilitación: Trastornos Musculoesqueléticos 13, que menciona que al síndrome doloroso postmastectomía se manifiesta a menudo en dolor fantasma de la mama y dolor neuropático en la pared torácica anterior/ lateral, la axila o la cara interna de la región superior del brazo. Este libro menciona como tratamiento inmediato para estas patologías el control de dolor, técnicas de desensibilización (desensibilización: procedimiento para reducir la sensibilidad mediante la exposición de zonas corporales a diversas texturas y presiones) y aumento de la movilidad el hombro, mientras que el tratamiento crónico incluye fármacos para el dolor, técnicas de intervención y rehabilitación. Basándose en expuesto en todo lo anterior, se muestra el cuadro 1, en el cual se observan las técnicas fisioterapéuticas a utilizar según los objetivos deseados para la Intervención Fisioterapéutica para el SdMFD.
Esta intervención tendrá como lineamientos generales los siguientes:
Frecuencia de las sesiones: 1 a 3 por semana con un día mínimo entre las sesiones (dependerá del nivel de dolor según EVA, y el nivel de las sensaciones, síntomas y percepciones fantasma).
Espacio entre las sesiones: un día mínimo, 8 días máximo.
Duración de las sesiones: 45 minutos a una hora.
Cantidad de sesiones: Mínimo 6, revalorar y registrar resultados y progreso, máximo 20 sesiones. De no ver progresos positivos, remitir a otro profesional de salud, médico, Fisiatra, Médico Físico, Psicólogo, Psico-oncólogo, otros.
Combinación de las técnicas utilizadas en cada sesión:
1. Técnica manual a elegir dependiendo de objetivos de la sesión.
2. Técnicas de desensibilización son de aplicación obligatoria.
3. Técnica analgésica (Técnica manual, TENS, Crioterapia).
4. Educación de las técnicas y recomendaciones para el hogar.
Cuadro1. Técnicas fisioterapéuticas para la intervención del síndrome de mama fantasma doloroso en mujeres mastectomizadas por cáncer de mama.
|
Objetivo |
Abordaje |
Dosificación |
|
|
Terapia Manual |
Trabajar adherencias de la cicatriz. |
Masaje Transversal de Tejido Profundo (Cyriax). |
1 a 3 minutos, inclusive 10 minutos, con el super dedo, movimientos en dirección transversal a la cicatriz, esta debe estar cerrada. |
|
Disminuir dolor. Reducir tensión muscular. Prevenir restricciones de la movilidad del hombro. |
Queda a criterio del profesional elegir según los objetivos y valoración la técnica que se ajuste más a las necesidades de la persona atendida. Estimulación de puntos gatillos Liberación Miofascial Masaje Terapéutico |
10-15 minutos. Ninguna de las técnicas se debe realizar directamente en la zona si aún el cáncer está activo. Trabajar TrPs en músculos del cuello y del hombro (músculo Pectoral Mayor, Infraespinoso y Trapecio Superior ipsilateral) Aplicar intervenciones miofasciales dirigidas a los músculos de la pared torácica. Aplicar sobre zona afectada ya sea zona de amputación o zonas con irradiación del dolor, zonas contracturadas o tensas. Se puede trabajar la zona dorsal y lumbar. Se puede realizar en zonas tensas effleurage, petrissage, fricciones, compresiones, amasamiento digital, estiramientos pasivos, asistidos, percusiones, movimientos circulares con dedos centrífugamente, entre otros movimientos. |
|
|
Recuperar la Mecanosensibilidad normal. |
Neurodinámica |
Maniobra UTLN1 para nervio mediano, realizar una serie de 15 repeticiones una vez al día. Se recomienda además otras técnicas de neurodinámicas que movilicen las ramas del plexo braquial, para tratar el dolor referido hacia cuello y brazo. Enseñar a la persona a replicar la técnica en casa frente el espejo. |
|
|
Desensibilización. |
Estas técnicas pueden ser progresivas entre ellas o no según la condición de la persona. Programas de Sensibilización. Técnicas de Jerarquización Progresiva del Estímulo. Recuperar la función normal de termorreceptores cutáneos. |
5 a 10 minutos 3 o 4 veces por día, una vez durante la sesión, y las demás, en la casa como tarea a la persona. La demostración durante la sesión deberá realizarse en el lado no afectado, y repetirlo con retroalimentación y estimulación verbal en el lado afectado. Se aplica en caso de que la persona perciba disestesias. Informar a la persona sobre la técnica, sobre lo que va a sentir y lo que debería sentir. Realizar roces con la punta de los dedos varias veces y fomentar con retroalimentación verbal. Progresión de texturas, se puede iniciar realizando un contacto superficial con telas de seda, algodón, velcro suave hasta llegar a velcro áspero con telas suaves Progresión de Vibraciones, utilizando un diapasón inicialmente, e ir progresando con instrumentos que generen vibraciones más fuertes como un cepillo dental eléctrico, afeitadora, masajeador eléctrico, otros. Presión Sostenida, en caso que la persona no soporte los roces con texturas, pero si tolere la presión mantenida. Realizar roces con objetos a diferentes temperaturas, primero en la zona no afectada y luego con estímulo verbal y retroalimentación en la afecta. |
|
|
Recuperar la sensibilidad en la zona afectada. |
|||
|
Crioterapia |
Disminuir el dolor. |
Criomasaje |
10 minutos. Aplicar un masaje de forma circular con un hielo en cubito, o Ice-Rolling, directamente en puntos gatillos o en una zona no mayor a 15cm2. Se le debe decir a la persona que sentirá frío, quemazón, ligero dolor y entumecimiento o insensibilidad, al llegar a este punto, se detiene la aplicación. |
|
TENS |
Disminuir el dolor. |
TENS convencional |
Tiempo mayor a 30 minutos, con intensidad a tolerancia de la persona, sobre la zona donde refiera algia durante, o a lo largo del recorrido del dermatoma donde se perciba mayor dolor Fantasma. Localización de electrodos: -Directamente sobre la zona amputada (considerar contraindicaciones). -Contralateral. -Recorrido de nervios periféricos o dermatomas T1-T5. Nota:Considerar presencia de marcapasos |
|
Kinisio Tape |
Disminuir aferencias nociceptivas mediante la acción neurorefleja y la acción analgésica. |
Técnica de liberación de espacio en asterisco. Técnica en “I”. |
La herida debe estar cerrada. Sobre la zona pectoral sin tensión en anclajes ni cuerpo del KT, la persona debe estirar el músculo pectoral (sacando pecho) para elongar la piel. Aplicar a lo largo del dermatoma correspondiente a la zona que presenta dolor fantasma se coloca la base lateral de la vértebra dorsal de la salida de la raíz nerviosa correspondiente al dermatoma trabajado y el anclaje cerca del esternón, sin tensión. La persona adoptaría una postura de flexión leve de columna con lateralización contralateral del lado de la aplicación, abrazando su cabeza para lograr estirar la piel |
Fuente: Elaboración del autor basada en las referencias 13,29-37,40-42,44,45,47-53,55-58,62-64,68. 21-33
Conclusión
Durante mucho tiempo se apartó al fisioterapeuta del área de oncología e incluso se contraindicó el ejercicio a personas con diagnóstico de cáncer. Sin embargo, hoy en día se ha visto su importancia al desempeñar un papel fundamental en el área paliativa, pre habilitación y rehabilitación de la persona oncológica.
Se han realizado diversos esfuerzos para introducir al fisioterapeuta en oncología, ya que brinda una serie de herramientas factibles, eficaces y confiables para ayudar a mitigar efectos del cáncer y consecuencias del tratamiento oncológico.
Se deben realizar más estudios donde se demuestre los verdaderos efectos de diferentes modalidades fisioterapéuticas y poder guiar el tratamiento fisioterapéutico con bases teóricas y no con miedo sin fundamento científico a causar más daño.
En la presente propuesta se podría incluir además otras técnicas como la terapia de espejo y la desensibilización ocular, ya que, durante la investigación realizada, se encontró artículos que mencionan su uso en el tratamiento del miembro fantasma en la persona amputada.
Se propone en un futuro aplicar la propuesta elaborada para conocer sus alcances reales en la población con SdMFD.
Referencias Bibliográficas
1. Global Cancer Observatory [Internet]. Lyon: Globocan; 2012. Disponible en: http://globocan.iarc.fr/Pages/fact_sheets_population.aspx
2. Consenso Nacional de Especialistas en Cáncer. Consenso costarricense sobre prevención, diagnóstico y tratamiento del cáncer mamario [Internet]. San José, CR: Consenso Nacional de Especialistas en Cáncer; 2016. Disponible en: http://www.medicos.cr/consensocancer/documentos/consenso%20de%20mama%202016%20v7.pdf
3. Cáncerheville Al, Tchou J. Barriesrs to rehabilitation following surgery for primary breast cancer. J Surg Oncol. 2007;95(5):409-418. doi: 10.1002/jso.20782
4. Wallace MS, Wallace AM, Lee J, Dobke MK. Pain after breast surgery a survey of 282 women. Pain. 1996;66(2-3):195-205. doi: 10.1016/0304-3959(96)03064-3
5. Martínez Ramos D, Alcalde M, Rivadulla MI, Daroca JM, Paiva AG, Fortea C, et al. Síndrome de la mama fantasma tras mastectomía. Rev Senol Patol Mam [Internet]. 2010;23(2):75-76. Disponible en: https://www.sespm.es/wp-content/uploads/revista/2010_23_2/8.pdf
6. Gilbert R, Gonzáles MD. Dolor en los miembros fantasma y dolor de muñón. Rev Soc Esp Dolor. 1996;3:283-289.
7. Markopoulos CJ, Spyropoulou AC, Zervas IM, Christodoulou GN, Papageorgiou C. Phantom breast syndrome: The effect of in situ breast carcinoma. Psychiatry Res. 2010;179(3):333-7. doi: 10.1016/j.psychres.2009.08.016.
8. Guerreiro Godoy Mde F, Pereira de Godoy AC, de Matos MJ, Guimarães TD, Barufi S. Phantom breast syndrome in women after mastectomy. Breast J. 2013;19(3):349-50. doi: 10.1111/tbj.12115.
9. Rothemund Y, Schaefer M, Grüsser SM, Flor H. Localization of the human female breast in primary somatosensory cortex. Exp Brain Res. 2005;164(3):357-64. doi: 10.1007/s00221-005-2257-2.
10. Dijkstra PU, Rietman JS, Geertzen JH. Phantom breast sensations and phantom breast pain: a 2-year prospective study and a methodological analysis of literature. Eur J Pain. 2007;11(1):99-108. doi: 10.1016/j.ejpain.2006.01.002.
11. Vilholm OJ, Cold S, Rasmussen L, Sindrup SH. The postmastectomy pain syndrome: an epidemiological study on the prevalence of chronic pain after surgery for breast cancer. Br J Cancer 2008;99(4):604-10. doi: 10.1038/sj.bjc.6604534.
12. Jung BF, Ahrendt GM, Oaklander AL, Dworkin RH. Neuropathic pain following breast cancer surgery: proposed classification and research update. Pain. 2003;104(1-2):1-13. doi: 10.1016/s0304-3959(03)00241-0.
13. Frontera W, Silver J, Rizzo T. Manual de medicina física y Rehabilitación: Trastornos musculoesqueléticos, dolor y rehabilitación. 4a ed. Barcelona: Elsevier; 2020.
14. Borges da silva B, Cronemberger Maia Mendes L, Braga Costa N, Guimarães Martins L, Portela Lima G, Mendes Teles JB, Vieira SC. Síndrome da mama fantasma: características clínicas y epidemiológica. Rev Bras Ginecol Obstet. 2007;29(9):446-451. doi: 10.1590/S0100-72032007000900002.
15. Manterola Carlos D, Zavando Daniela M. Cómo interpretar los “Niveles de Evidencia” en los diferentes escenarios clínicos. Rev Chil Cir. 2009;61(6):582-295. doi:10.4067/S0718-40262009000600017.
16. Erbas B, Provenzano E, Armes J, Gertig D. The natural history of ductal carcinoma in situ of the breast: a review. Breast Cancer Res Treat. 2006;97(2):135-44. doi: 10.1007/s10549-005-9101-z.
17. Faria SS, Freitas Junior R, Silva PL. Prevalência e Perfil Clínico da Síndrome de Mama Fantasma: Revisão Integrativa. Rev Bras Cancerol [Internet]. 2013;59(1):113-122. Disponible en: https://repositorio.bc.ufg.br/bitstream/ri/18303/5/Artigo%20-%20Sara%20Socorro%20Faria%20-%202013.pdf
18. Harris JR, Lippman ME, Morrow M, Hell S. editors. Diseases of the breast. 4a ed. Filadelfia: Wolters Kluwer; 2010.
19. Melzack R. Phantom limbs and the concept of a neuromatrix. Trends Neurosci. 1990;13(3):88-92. doi: 10.1016/0166-2236(90)90179-e.
20. Giummarra MJ, Gibson SJ, Georgiou-Karistianis N, Bradshaw JL. Mechanisms underlying embodiment, disembodiment and loss of embodiment. Neurosci Biobehav Rev. 2008;32(1):143-60. doi: 10.1016/j.neubiorev.2007.07.001.
21. Ramirez Medina JM, Nogueira Fabro EA, Silva BA, Santos Thuler LC, Bergmann A. Frequência e fatores associados à síndrome da mama fantasma em mulheres submetidas à mastectomia por câncer de mama. Rev Bras Ginecol Obstet. 2015;37(9):397-401. doi: 10.1590/SO100-720320150005353
22. Björkman B, Lund I, Arnér S, Hydén LC. Phantom phenomena: their perceived qualities and consequences from the patient’s perspective. Scand J Pain. 2012;3(3):134-40. doi: 10.1016/j.sjpain.2012.02.007.
23. Ishyama H, Niino K, Hosoya T, Hayakawa K. Results of a questionnaire survey for symptom of late complications caused by radiotherapy in breast conserving therapy. Breast Cancer. 2006;13(2):197-201. doi: 10.2325/jbcs.13.197.
24. Katz J, Melzack R. Pain “memories” in phantom limbs: review clinical observations. Pain. 1990;43(3):319-336. doi: 10.1016/0304-3959(90)90029-d.
25. Wartan SW, Hamann W, Wedley JR, McColl I. Phantom pain and sensation among British veteren amputees. Br J Anesth. 1997;78(6):652-659. doi: 10.1093/bja/78.6.652.
26. Jensen TS, Rasmussen P. Phantom pain and other phenomena after amputation. En: Wall PD, Meltzack R, editors. Textbook of Pain. 3a ed. Londres: Churchill Livingstone; 1994. 651–665.
27. García Lafuente M, Veiga Agüeros F, Cerezo Téllez E. Efectividad de los tratamientos de Fisioterapia en el dolor de miembro fantasma Revisión sistemática cualitativa. Cuest Fisioter. 2019;48(3):202-212.
28. Serra Catafau J. Tratado de dolor neuropático. Buenos Aires: Médica Panamericana; 2006.
29. Weeks SR, Anderson-Barnes VC, Tsao JW. Phantom limb pain: theories and therapies. Neurologist. 2010;16(5):277-86. doi: 10.1097/NRL.0b013e3181edf128
30. Johnson M. Transcutaneous Electrical Nerve Stimulation: Mechanisms, Clinical Application and Evidence. Rev Pain. 2007;1(1):7-11. doi: 10.1177/204946370700100103.
31. Iacono RP, Linford J, Sandyk R. Pain management after lower extremity amputation. Neurosurgery. 1987;20(3):496-500. doi: 10.1227/00006123-198703000-00027.
32. Katz J, France C, Melzack R. An association between phantom limb sensations and stump skin conductance during transcutaneous electrical nerve stimulation (TENS) applied to the contralateral leg: a case study. Pain. 1989;36(3):367-77. doi: 10.1016/0304-3959(89)90098-5.
33. Vaquerizo A. Postamputation pain. Rev Soc Esp Dolor [Internet]. 2000;7(Supl. II):60-77. Disponible en: http://revista.sedolor.es/pdf/2000_10_09.pdf
34. Frontera W, editor. Delisa Physical Medicine and Rehabilitation, Principles and practice. 5a ed. Philadelphia: Lippincott-Williams & Wilkins; 2010.
35. Mulvey MR, Bagnall AM, Johnson MI, Marchant PR. Transcutaneous electrical nerve stimulation (TENS) for phantom pain and stump pain following amputation in adults. Cochrane Database Syst Rev. 2010;(5):CD007264. doi: 10.1002/14651858.CD007264.pub2.
36. Mulvey MR, Radford HE, Fawkner HJ, Hirst L, Neumann V, Johnson MI. Transcutaneous electrical nerve stimulation for phantom pain and stump pain in adult amputees. Pain Pract. 2013;13(4):289-96. doi: 10.1111/j.1533-2500.2012.00593.x.
37. Álvarez Y, Silva M, Tipacti I. Eficacia de la corriente de electroestimulación nerviosa transcutánea convencional en el alivio del dolor fantasma del miembro inferior [Tesis de Licenciatura en Tecnología Médica en la Especialidad de Terapia Física y Rehabilitación]. Lima: Universidad Peruana Cayetano Heredia; 2015. Disponible en: http://repositorio.upch.edu.pe/handle/upch/531
38. Curties D. Massage Therapy and Cancer. Canadá: Curties-Overzet Publication; 1999.
39. Chavero Claver I. Masaje y drenaje linfático manual, en pacientes bajo tratamiento para el cáncer de mama [Internet]. Madrid: Instituto de Cirugía Plástica Martín del Yerro; 2003.
40. Mas Esquerdo J, Maruenda Fernández R, Robles Sánchez J. Tratamiento neuropsicológico de «dolor de miembro fantasma» a propósito de un caso. Sanid mil [Internet]. 2013;69(3):195-202. Disponible en: http://scielo.isciii.es/pdf/sm/v69n3/comunicacion1.pdf
41. Corbin L. Safety and Efficacy of Massage Therapy for patients with cancer. Cancer control. 2005;12(3):158-164. doi: 10.1177/107327480501200303.
42. Moyer CA, Rounds J, Hannum JW. A meta-analysis of massage therapy research. Psychol Bull. 2004;130(1):3-18. doi: 10.1037/0033-2909.130.1.3.
43. Fruth SJ. Differential diagnosis and treatment in a patient with posterior upper thoracic pain. Phys Ther. 2006;86(2):254-68.
44. Crawford JS, Simpson J, Crawford P. Myofascial release provides symptomatic relief from chest wall tenderness occasionally seen following lumpectomy and radiation in breast cancer patients. Int J Radiat Oncol Biol Phys. 1996 ;34(5):1188-9. doi: 10.1016/s0360-3016(96)90035-8.
45. Fernández Lao C, Cantarero Villanueva I, Fernández de Las Peñas C, Del Moral Ávila R, Arendt-Nielsen L, Arroyo Morales M. Myofascial trigger points in neck and shoulder muscles and widespread pressure pain hypersensitivtiy in patients with postmastectomy pain: evidence of peripheral and central sensitization. Clin J Pain. 2010;26(9):798-806. doi: 10.1097/AJP.0b013e3181f18c36.
46. Kudel I, Edwards RR, Kozachik S, Block BM, Agarwal S, Heinberg LJ, et al. Predictors and consequences of multiple persistent postmastectomy pains. J Pain Symptom Manage. 2007;34(6):619-27. doi: 10.1016/j.jpainsymman.2007.01.013.
47. Hamada H, Moriwaki K, Shiroyama K, Tanaka H, Kawamoto M, Yuge O. Myofascial pain in patients with postthoracotomy pain syndrome. Reg Anesth Pain Med. 2000;25(3):302-5. doi: 10.1016/s1098-7339(00)90016-6.
48. Cheville AL, Tchou J. Barriers to rehabilitation following surgery for primary breast cancer. J Surg Oncol. 2007;95(5):409-18. doi: 10.1002/jso.20782.
49. Cummings M. Myofascial pain from pectoralis major following trans-axillary surgery. Acupunct Med. 2003;21(3):105-7. doi: 10.1136/aim.21.3.105.
50. Cinar N, Seckin U, Keskin D, Bodur H, Bozkurt B, Cengiz O. The effectiveness of early rehabilitation in patients with modified radical mastectomy. Cancer Nurs. 2008;31(2):160-5. doi: 10.1097/01.NCC.0000305696.12873.0e.
51. Caro-Morán E, Díaz-Rodríguez L, Cantarero-Villanueva I, Galiano-Castillo N, Arroyo-Morales M, Fernández-Lao C. Nerve pressure pain hypersensitivity and upper limb mechanosensitivity in breast cancer survivors: a case-control study. Pain Med. 2014;15(10):1715-23. doi: 10.1111/pme.12567.
52. López Cubas C. Osteon Fisioterapia [Internet]. Valencia: Osteon Fisioterapia; 2014. Neurodinámica y cáncer de mama; [aprox 1 pantallas]. Disponible en: https://carloslopezcubas.com/2014/09/neurodinamica-y-cancer-de-mama.html
53. Rosa I. Neurodinamia del plexo braquial en el cáncer de mama [Tesis Doctoral]. Alcalá de Henares: Universidad de Alcalá, 2016. Disponible en: https://www.educacion.gob.es/teseo/imprimirFicheroTesis.do?idFichero=bYoyjnq034k%3D
54. Nee R, Butler D. Management of peripheral neuropathic pain: Integrating neurobiology, neurodynamics, and clinical evidence. Phys Ther Sport. 2006; 7:36-49. doi: 10.1016/j.ptsp.2005.10.002
55. Salas Moreno L. Tratamiento Preprotésico en una Amputación de Miembro Superior con Síndrome del Miembro Fantasma [Tesis de grado en Terapia Ocupacional]. Zaragoza: Universidad de Zaragoza; 2013. Disponible en: https://zaguan.unizar.es/record/12163/files/TAZ-TFG-2013-780.pdf
56. Mas Esquerdo J, Maruenda Fernández R, Robles Sánchez J. Tratamiento neuropsicológico de «dolor de miembro fantasma» a propósito de un caso. Sanid mil [Internet]. 2013;69(3):195-202. Disponible en: http://scielo.isciii.es/pdf/sm/v69n3/comunicacion1.pdf
57. Flor H, Denke C, Schaefer M, Grüsser S. Effect of sensory discrimination training on cortical reorganisation and phantom limb pain. Lancet. 2001;357(9270):1763-4. doi: 10.1016/S0140-6736(00)04890-X
58. Polonio B. Terapia Ocupacional en Discapacitados Físicos. Teoría y Práctica. Madrid: Médica Panamericana; 2004.
59. Berne T, Levy M. Cardiovascular Physiology. St Louis: Mosby.
60. Lee JM, Warren MP, Mason SM. Effects of ice on nerve conduction velocity. Physiotherapy. 1978;64(1):2-6.
Ernst E, Fialka V. Ice freezes pain? A review of the clinical effectiveness of analgesic cold therapy. J Pain Symptom Manage. 1994;9(1):56-9. doi: 10.1016/0885-3924(94)90150-3.
61. Jordá Llona M. Efectos de la administración precoz de gabapentina en el dolor de miembro fantasma postamputación [Tesis Doctoral]. Valencia: Universidad de Valencia; 2005.
62. Ribera H, Cano P, Dora A and Garrido GP. Dolor de miembro fantasma tras hematoma de muñón postraumático 40 años después de la amputación: a propósito de un caso. Rev Soc Esp Dolor [Internet]. 2001;8(3):217-220. Disponible en: http://revista.sedolor.es/pdf/2001_03_09.pdf
63. Alós Villacrosa J. Amputaciones del miembro inferior en cirugía vascular. Un problema multidisciplinar. Barcelona: Editorial Glosa; 2008.
64. Thelen MD, Dauber JA, Stoneman PD. The clinical efficacy of kinesio tape for shoulder pain: a randomized, double-blinded, clinical trial. J Orthop Sports Phys Ther. 2008;38(7):389-95. doi: 10.2519/jospt.2008.2791.
65. Méndez Vanega DA. Efectos del vendaje neuromuscular en el paciente amputado de miembro inferior y miembro superior en su etapa posoperatoria [Tesis de Grado]. Guatemala: Universidad Rafael Landívar. Disponible en: http://recursosbiblio.url.edu.gt/tesiseortiz/2016/09/01/Mendez-David.pdf
66. Williams S, Whatman C, Hume PA, Sheerin K. Kinesio taping in treatment and prevention of sports injuries: a meta-analysis of the evidence for its effectiveness. Sports Med. 2012;42(2):153-64. doi: 10.2165/11594960-000000000-00000.